“水循环”、“氧循环”和“碳循环”是自然界存在的三大重要循环。结合你所学到的化学知识回答下面有关问题。
(1)从物质变化的角度看,三大循环中有一种变化与另外两种变化有本质的区别,这一循环是 ,这种循环主要是由 的运动引起的。
(2)从微观角度看,水分子是由 构成的;从宏观角度看,二氧化碳是由 组成的。
(3)下图表示水、二氧化碳和氧气的循环图。
①图中A是自然界中消耗二氧化碳的主要途径,其名称为 。
除此以外,自然界中消耗二氧化碳的另一主要途径为海水吸收,此过程发生反应的化学方程式为 。
②请各举一例实现图中所示的物质变化,写出有关反应的化学方程式。
变化b化学方程式 。
变化c化学方程式 。
变化d化学方程式 。
(4)在刚刚结束的“两会”上提出:今年二氧化碳排放强度要降低3.1%以上,二氧化硫、氮氧化物排放要分别减少3%左右和5%左右。请回答下列问题:
①现行空气质量日报中,未计入空气污染指数项目的是: (填序号)
A.二氧化碳
B.二氧化硫
C.氮氧化物
D.可吸入颗粒物
E.臭氧
②大气中的CO2含量不断上升引起的环境问题是 。
大气中的CO2是不是越少越好?为什么? 。
③人类降低空气中CO2含量的两个研究方向:一是增强对CO2的吸收,别一个是减少排放。“低碳经济”是一种以低能耗和高效能等为主要特征,以较少的二氧化碳排放获得较大产出的新经济发展模式。下列做法中不符合“低碳经济”理念的是 (填序号)
A.为了节约用纸,两面使用草稿纸
B.为了“QQ”能够升级,长期把“QQ”挂在线上
C.减少使用私加车次数,多乘公交车、骑自行车或步行
D.开发新能源,逐渐取缔直接利用化石燃料的历史
(5)研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标,目前液氨被人们被为一种潜在的清洁燃料。
①氨气在空气中充分燃烧的产物是氮气和水,试写出氨气燃烧反应的化学方程式 。
②液氨和液氢燃料相比有关数据见下表,据此判断正确的是 (填序号)
| 燃料 |
沸点(℃) |
燃烧放热(kJ/g) |
相对分子质量 |
爆炸极限 |
液态密度(g/cm3) |
| 氢 |
-252.6 |
119.20 |
2.0 |
4.0%~75.6% |
0.07 |
| 氨 |
-33.50 |
18.65 |
17.0 |
16%~25% |
0.61 |
A.以氨和氢为燃料时,可以减缓温室效应
B.氨泄漏到空气中比氢气更易发生爆炸
C.等质量的氨和氢分别燃烧,氢放出的热量多
D.氨的液化比氢容易得多。
③在实验室中为探究氨气的性质,常用碱石灰和硫酸铵两种固体混合加热的方法制取氨气。通常情况下,氨气是一种极易溶于水,密度比空气小的气体。
请回答下列问题:
实验室制取氨气时发生装置 (填字母序号,下同)在C、D、E 三种装置中,收集氨气应选择 若用装置F 收集氨 气,则应将 (填“c”或”d”)与发生装置相连接。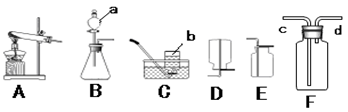
如图为世界最长的跨海大桥﹣﹣港珠澳大桥,于2018年10月24日正式通车,凸显了我国领先的造桥技术。回答下列问题:
(1)建造大桥使用了大量钢材、水泥、玻璃、橡胶等材料,其中属于有机物的是 ,能导电的是 。
(2)造桥用的钢管浸泡在海水中易发生腐蚀,造成钢管腐蚀的物质包括水、二氧化碳、 。

如图是硝酸钾和氯化铵的溶解度曲线图(如图1所示),某化学兴趣小组用物质R进行了如图2所示的实验,按要求完成以下问题。
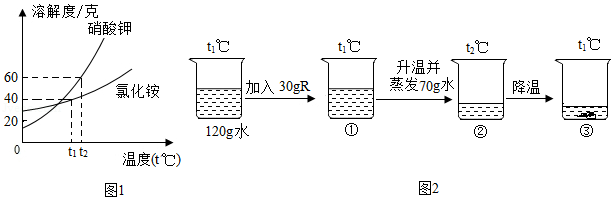
(1)t1℃时将50g的氯化铵加入到80g的水中,此时所形成溶液的质量等于 克。
(2)①溶液的溶质的质量分数 ②溶液的溶质的质量分数(填“<”“>”或“=”)。
铝碳酸镁咀嚼片的主要成分是AlMg(OH)3CO3可治疗胃酸过多症,写出其发生反应的化学方程式 。
2019年5月16日,我国“海洋六号”科考船在深海的冷泉周围收集到可燃冰。在深海潜水器或潜水艇中可用过氧化钠(Na2O2)来除去动物呼吸作用所产生的二氧化碳并提供呼吸所需的气体,且生成一种俗称纯碱的物质,写出该反应的化学方程式 。
海洋是一个聚宝盆。我国钓鱼岛海域蕴藏了丰富的水资源、油气资源。
(1)丙烷(C 3H 8)是石油的成分之一,写出丙烷充分燃烧的化学方程式 。
(2)我国渔民长期在钓鱼岛以捕鱼为生。鱼中含有丰富的 (填字母,只有一个选项)。
A.糖类 B.维生素 C.脂肪 D.蛋白质
(3)若将海水取回后滴加硝酸银,写出发生反应的化学方程式 。