“摩尔盐”[(NH4)2Fe(SO4)2·6H2O是分析化学中的重要试剂。查阅文献得知:“摩尔盐”隔绝空气加热至500℃时可完全分解,但产物复杂。某学习小组欲探究其分解产物。
I.【提出猜想】摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
经认真分析,通过推理即可确定,猜想____ 不成立(填序号)。
II.【实验探究】为检验分解产物,甲同学设计了如下实验装置。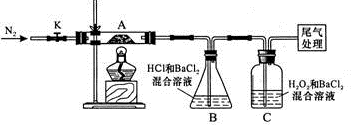
请回答下列问题:
(1)B装置的容器名称是 。
(2)取一定量“摩尔盐”置于加热管A中,加热至分解完后打开K,再通入N2,目的是 。
(3)观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为 。
(4)待A中剩余固体冷却至室温后,取少量置于试管中,加入稀硫酸溶解,再滴几滴KSCN溶液,可以观察到的现象是 。
(5)乙同学设计实验验证A中残留物不含FeO,操作方法及实验现象是:取少量A中残留物放入试管中, 。
III.【实验反思】
乙同学认为:装置B中产生白色沉淀不能证明分解产物中一定含SO3,原因是____ 。
乙烯与液溴作用制取1,2—二溴乙烷的装置如下(D中试管里所装物质为液溴)
1,2—二溴乙烷的主要物理性质是
| 熔点 |
沸点 |
密度 |
溶解性 |
| 9.79℃ |
131.4℃ |
2.18g·cm-3 |
难溶于水,易溶于醇、醚等 |
(1)A是乙醇制备乙烯的反应装置图,B、D中所盛都是水,其中D装置中水的作用是______________
(2)C和E所盛都是NaOH溶液,它们的作用分别是:
C_____________________、E_________________
(3)写出以乙醇、浓硫酸、液溴为主要原料生成1,2—二溴乙烷的主要化学反应方程式____________________、________________
氯离子插层镁铝水滑石[Mg2Al(OH)6Cl·xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气,冷却玻管B能降低气体的温度,但不能液化水蒸气。现用下图装置进行实验确定其化学式(固定装置略去)。
(1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式为 。
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为 (按气流方向,用接口字母表示),其中C的作用是 。装置连接后,首先要进行的操作是 。
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,加热过程中持续通入N2的作用是 ,停止加热后的冷却过程中仍要持续通入N2的作用是_。
(4)完全分解后测得C增重3.65 g、D增重9.90 g,则x= 。若取消冷却玻管B后进行实验,测定的x值将 (填“偏高”或“偏低”)。
人体血液里Ca2+离子的浓度一般采用g/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
【配制KMnO4标准溶液】下图是配制50mLKMnO4标准溶液的过程示意图。
(1)上述过程中有两处错误,请你观察图示判断其中不正确的操作是(填序号)____________;
(2)如果按照图示的操作配制溶液,所得的实验结果将____________(填偏大或偏小)。
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用酸化的0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)滴定时高锰酸钾需要酸化,从括号中选择酸化高锰酸钾溶液所用的酸(硫酸、盐酸、硝酸) ,确定反应达到终点的现象_____________________________。
(4)写出草酸跟酸性KMnO4溶液反应的离子方程式为: ;反应中若转移0.2mol 电子生成标准状况下CO2气体的体积为 L。
(5)根据所给数据计算血液样品中Ca2+离子的浓度为________mg/cm3。
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品。用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是利用盐酸和石灰石制取CO2的装置,A中发生反应的化学方程式为_____________.
(2)填写表中空格:
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________________。
在此反应中,过氧化钠的作用是_______(填序号) ①氧化剂;②还原剂;③既是氧化剂又是还原剂;④既不是氧化剂,又不是还原剂。
(4)试管F中收集满气体后,下一步实验操作是:___________________________。
为了保护环境,充分利用资源,某研究小组通过如图简化流程,将工业制硫酸的硫铁矿烧渣(含Fe2O3.SiO2.Al2O3等)转变成重要的工业原料FeSO4(反应条件略)
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是_____ _____.
(2)检验第II步中Fe3+是否完全还原,应选择__________(填字母编号).
| A.KMnO4溶液 | B.KSCN溶液 | C.KCl溶液 | D.KOH |
(3)第III步加FeCO3调溶液pH=6时,利用相关数据计算,(已知Ksp Al(OH)3=1.9×10﹣33,当离子浓度小于1×10﹣5mol•L﹣1时,可认为沉淀完全)判断Al3+_______(填“是”或“否”)能沉淀完全。
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是__________.
(5)FeSO4溶液在加热浓缩结晶时要注意_________________________________,FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2═Fe+2Li2S,正极反应式是__________.