(共16分)Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:
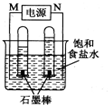
①燃料电池即电源的N极的电极反应式为 _______________________ ;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:
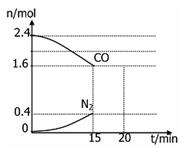
①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂
C.减小CO2的量 D.扩大容器体积
工业电解饱和食盐水模拟装置的结构如图所示:
(1)写出电解饱和食盐水的化学方程式 ,该工业称为 工业
(2)实际生产中使用的盐往往含有一些杂质,在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |
(3)在该装置中写出装NaOH溶液试管中所发生的化学反应方程式(并用双线桥表示电子的转移的方向和数目) 。
氨气是一种重要工业原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)=2NO(g) △ H=+180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=________________。
(2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是____________。
①增大压强②增大反应物的浓度 ③使用催化剂 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,画出反应及收集的简易装置;
实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
② 常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③ 将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)。如右图所示:
右边Cu电极反应式是 ,a电极的电极反应式
铜及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。
为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,请完成下列离子方程式:
Cu2S+ MnO4-+
MnO4-+ H+
H+
 Cu2++
Cu2++ SO42-+
SO42-+ Mn2++
Mn2++ H2O
H2O
(2)现有一块含有铜绿[Cu2(OH)2CO3]
的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。①固态铜与适量氧气反应,能量变化如图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式
②上述铜片中铜的生锈率为
苯硫酚(PhSH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(PhCl)和硫化氢(H2S)在高温下反应来制备苯硫酚,但会有副产物苯(PhH)生成。
I: PhCl(g)+H2S(g) PhSH(g)+HCl(g) △H1=—16.8kJ·mol-1
PhSH(g)+HCl(g) △H1=—16.8kJ·mol-1
II: PhCl(g)+H2S(g) ==PhH(g)+ HCl(g)+ S8(g) △H2
S8(g) △H2
回答下列问题:
(1)反应I为可逆反应,写出平衡常数的表达式K=_______________________,
反应II为不可逆反应,△H2=___________0。(填写“>”,“<”,“=”)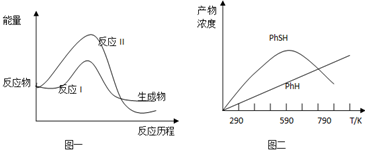
(2)上述两个反应的能量变化如图一所示,则在某温度时反应速度v(I)__________v(II)(填写“>”,“<”,“=”)
(3)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图二和图三。
①请解释图二中两条曲线的变化_______________________。
②若要提高主产物苯硫酚的产量,可采取的措施是______________________。
(4)请根据图二、图三,画出恒温恒容条件下反应主产物苯硫酚的物质的量随时间变化的曲线图。
氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步具有极其重要的意义。
(1)已知:2BrO3-+C12=Br2+2C1O3- ; 5C12+I2+6H2O=2HIO3+10HC1;
C1O3-+5C1-+6H+=3C12+3H2O
则C1O3-、BrO3-、IO3-、C12的氧化性由弱到强的排序为
(2)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明。(提示:请写出实验步骤、现象及结论)①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
(3)二十世纪初期,化学家合成出极易溶于水的NaBH4。在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以BO2-形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
(4)某强氧化剂[RO(OH)2]+ 能将Na2SO3氧化。已知含2.0×10-3 mol [RO(OH)2]+ 离子的溶液,恰好跟25.0 mL 0.2 mol/L 的Na2SO3溶液完全反应,则反应后R的化合价为 价。
(5)将32 g 铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①待产生的气体全部释放后,向溶液加入V mL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。(用含V、a的式子表示)
①欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要H202的质量为 g。