X、Y、Z、W是原子序数依次增大的短周期元素,X元素的族序数是周期序数的2倍;Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素最高化合价与最低化合价绝对值之差等于4;W元素在周期表中位于非金属性最强的元素下方。请回答:
(1)X元素在周期表中的位置是 ;W-离子的结构示意图为 。
(2)X元素可形成多种气态氢化物,其中相对分子质量为26的气态氢化物的电子式为 ;25℃、101kPa时该气态氢化物热值为5×104 kJ•kg-1,则其标准燃烧热为 。
(3)写出一种适宜实验室制取W单质的离子方程式: 。
(4)室温时金可溶于王水(浓盐酸和浓硝酸混合物)生成HAuCl4,若反应过程中消耗的氧化剂与还原剂物质的量相等,则该化学方程式为 。
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度(填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则(填“甲”或“乙”)判断正确。试剂X是。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH(填“高于”、“低于”或“等于”)8.3,则(填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言(填“甲”或“乙”)判断是错误的,理由是。
用标准酸液滴定待测碱液时,下列操作对所测碱液的物质的量浓度有何影响。
A、偏低 B、偏高 C、无影响
请用序号填空
(1)用待测液润洗锥形瓶后再注入所量取的一定体积待测液____________
(2)未用标准液润洗酸式滴定管就直接注入标准酸液_________________
(3)用滴定管尖端未排气泡的碱式滴定管量取待测碱液_________________
(4)滴定前仰视读数、滴定后俯视读数_______________________________
(5)锥形瓶未润洗,且瓶中有少量蒸馏水_____________________________
化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3+H2O 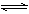 NH3·H2O
NH3·H2O 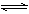 NH
NH +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向______移动,OH-的浓度_____,NH4+的浓度_______。
(2)向氨水中加入浓盐酸,平衡向______移动;
(3)向浓氨水中加入少量NaOH固体,平衡向_____移动,此时发生的现象是__________。
将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行离子的依次分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)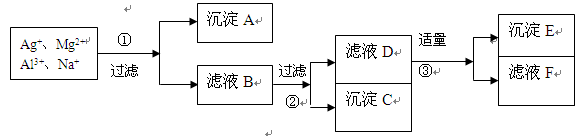
(1)沉淀A是 ___,沉淀C ___,沉淀E是;
(2)加入试剂①是 ____,②是________________,③是______________。
某种常见的白色晶体A,与盐酸反应产生无刺激性气味的气体B,将B通入澄清石灰水,石灰水变浑浊。若在A的水溶液中加氢氧化钡溶液微热,则析出白色沉淀C和无色气体D,D可以使湿润的红色石蕊试纸变蓝。加热固体A,可生成水、B和D,而且B和D的物质的量之比为1:1.根据以上事实,可以判断出A是,B是,C是。
加热固体A生成水、B和D的化学方程式是_____________,
A与盐酸反应的离子方程式___________________________________,
A与氢氧化钡溶液反应的离子方程式_______________________________________________。