丙烯醇( )是一种重要的有机合成原料。
)是一种重要的有机合成原料。
(1)丙烯醇中含有的官能团的化学符号是
(2)0.3mol丙烯醇与11.5g金属钠反应,能生成标准状况下的氢气_________ L。
(3)写出丙烯醇与溴水反应的化学方程式____________________________
(4)丙烯醇与CH3 CO 18OH发生酯化反应的化方程式为:_______________________
酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为________
(5)设计方案用丙烯醇合成丙烯,在下面空格中写出方案中涉及的所有化学反应方程式:
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g),△H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) , △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) ,△H2
SiO2(s)+CaO(s)=CaSiO3(s) ,△H3
用△H1、△H2和△H3表示△H,则△H=____________________;
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子产物,其结构式为_________,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________;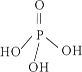
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2P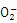 ,在酸性等条件下发生下述反应:
,在酸性等条件下发生下述反应:
(a)_____ Ni2+ + ____ H2P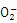 + _____ → ___Ni++______ H2P
+ _____ → ___Ni++______ H2P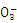 + ____
+ ____
(b)6 H2P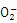 +2H+ =2P+4H2PO3+3H2↑
+2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:________________________________;
原理上的不同点:__________________________________;
化学镀的优点:____________________________________。
新的研究表明二甲醚(DME)是符合中国能源结构特点的优良车用替代燃料,二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g) + H2O(l)  2 CH3OH(l) △H=+24.52kJ/mol
2 CH3OH(l) △H=+24.52kJ/mol
②CH3OH(l) + H2O(l)  CO2(g) + 3H2(g) △H=+49.01kJ/mol
CO2(g) + 3H2(g) △H=+49.01kJ/mol
③CO(g) + H2O(l)  CO2(g) + H2(g) △H=-41.17kJ/mol
CO2(g) + H2(g) △H=-41.17kJ/mol
④CH3OH(l)  CO (g) + 2H2(g) △H=+90. 1kJ/mol
CO (g) + 2H2(g) △H=+90. 1kJ/mol
请回答下列问题:
(1)写出用二甲醚制H2同时全部转化为CO2时反应的热化学方程式___________。
(2)200℃时反应③的平衡常数表达式K=___________。
(3)在一常温恒容的密闭容器中,放入一定量的甲醇如④式建立平衡,以下可以作为该反应达到平衡状态的判断依据为___________。
A.容器内气体密度保持不变
B.气体的平均相对分子质量保持不变
C.CO的体积分数保持不变
D.CO与H2的物质的量之比保持1:2不变
(4)工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,

①你认为反应控制的最佳温度应为___________。
A.300~350℃ B.350~400℃ C.400~450℃ D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是___________(用相应的化学方程式表示)。
(5)某一体积固定的密闭容器中进行反应②,200℃时达平衡。请在下图补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,CO2的百分含量随时间变化图像。
(Ι)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)写出N的原子结构示意图:。
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,请写出反应的离子方程式:_____________________。
(Ⅱ)某暗紫色化合物A在常温和干燥的条件下,可以稳定存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为;化合物A与H2O反应的化学方程式为。
(2)化合物A可作为一种“绿色高效多功能”水处理剂,可由FeCl3和KClO在强碱性条件下反应制得,其反应的离子方程式为。
(3)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是。
A.醋酸钠 B.醋酸 C.Fe(NO3)3 D.KOH
(4)请设计一个实验方案,研究温度对化合物A水溶液稳定性的影响。
氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可生成NH3 和一种强碱。回答下列问题:
(1)氮化钠的电子式是,该化合物是化合物(选填“离子”、“共价”)。
(2)氮化钠与水反应的化学方程式是,该反应属于反应。
(3)氮化钠与盐酸反应生成种盐,其中(填盐的化学式)既含离子键又含有共价键。
(4)氮化钠中两种微粒的半径大小比较:r(Na+)r(N3-)(填“大于”、“小于”或“等于”)。
四种短周期非金属元素A、B、C、D,原子序数依次增大。A是原子半径最小的元素, B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是__________。
(2)化合物CA3的电子式是______________。
(3)BD2与淡黄色固体反应生成D2的反应方程式:_____________________。
(4)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为__________。