元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)氧化性最弱的简单阳离子的结构示意图是 。
(3)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式 。
(4)Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
(5)已知:2SO2(g)+O2(g) 2SO3(g) 平衡常数为K1
2SO3(g) 平衡常数为K1
2NO(g)+O2(g) 2NO2(g) 平衡常数为K2
2NO2(g) 平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数为K3= (用K1、K2来表达)
SO3(g)+NO(g)的平衡常数为K3= (用K1、K2来表达)
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO2和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式 。
有以下几种物质:①NaOH ②HCl ③SO2④CaCO3⑤Fe2O3。回答有关问题:
(1)属于碱性氧化物的是_______(填编号);
(2)具有漂白性的物质是(填编号);
(3)③与过量①的溶液反应的离子方程式为;
(4)①常常用于吸收多余的氯气,反应的化学方程式为。
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下: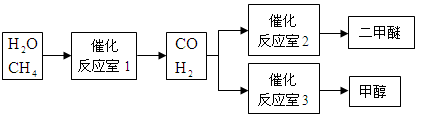
根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为。
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g)ΔH= -90.8kJ·mol-1
CH3OH(g)ΔH= -90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH= -23.5kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH= -23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)ΔH= -41.3kJ·mol-1
CO2(g)+H2(g)ΔH= -41.3kJ·mol-1
完成热化学反应方程式:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH=。
CH3OCH3(g)+CO2(g);ΔH=。
T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为。
(2)前2 min,v(A)=______________ mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3)制备绿矾(FeSO4·7H2O)并测定烧渣中铁元素的含量,流程图如下:
(1)操作a的名称是。
(2)加入足量试剂X后,发生反应的离子方程式为、。
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是、。
(4)硫铁矿烧渣中铁元素的质量分数为。
A~G是中学化学常见物质,其中A为相同条件下密度最小的气体单质,E为红棕色气体。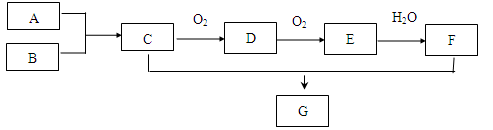
(1)G的化学式是。
(2)A和B反应生成C的化学方程式为。
(3)检验C可选用的试剂是(填字母)。
a.湿润的蓝色石蕊试纸 b.湿润的红色石蕊试纸 c.浓盐酸
(4)将盛满气体E的大试管倒扣在盛水的水槽中,发生反应的化学方程式为,现象为。
(5)汽车尾气中含有CO和物质D,一种治理方法是在汽车排气管上装一个催化转化装置,使CO和D反应,生成另外两种无毒气体。该反应的化学方程式是。