【2015重庆理综化学】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是 。
| A.降低了反应的活化能 | B.增大了反应的速率 |
| C.降低了反应的焓变 | D.增大了反应的平衡常数 |
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为 ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
(1)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)===2CO(g)ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:____________________。
(2)在25℃,101KPa时,CO的燃烧热为280kJ/mol,写出 CO的燃烧热的热化学方程式:____________________________。
(3)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应与能量关系如下,
请写出该反应的热化学方程式 :_______________________________________。
元素周期表是学习化学的重要工具,它隐含许多信息和规律。以下为元素周期表的一部分:
(1)C的元素符号_____________。 d位于第____周期、第_______族。
(2)通常状况状态为液体的单质颜色为。
(3)相同大小的a、b两种元素的单质分别投入热坩埚中,反应较剧烈的是______。(写元素符号)
(4)d元素的某种核素可用于考古时测定文物的年代,写出该核素的符号。
(5)写出d与f对应氢化物的化学式并比较其热稳定性>。g对应的最高价氧化物的水化物的化学式为。
(6)h元素的单质与e对应的10e-分子反应的化学方程式为________________________。
(1)某温度下,2 L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则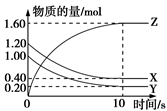
①反应的化学方程式为___________________________________________________;
②0~10 s内,用Z表示的化学反应速率____________________________________;
③X的转化率为__________________;(转化率是指平衡时某物质反应的物质的量与起始物质的量的百分比)
(2)在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是()
2C(g)达到平衡的标志是()
A.A的生成速率与C分解的速率相等
B.单位时间内生成nmolA,同时生3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1:3:2
下表是元素周期表的短周期部分,表中字母分别表示一种元素。
请回答下列问题:
(1)g与b可形成离子化合物b2g2,该物质含有的化学键类型有 ________。
(2)e、f、g三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示)________。
(3)从化合物c2g3与eg2组成的混合物中分离提纯eg2,可加入上述________(用元素符号表示)两种元素形成化合物的水溶液后再过滤洗涤。
(4)a、d两种元素可形成多种化合物,其中化合物X的产量是衡量一个国家石油化工发展水平的标志。X可与H2O在一定条件下反应生成化合物A,该反应的化学方程式为:________________________。
(5)航天技术中常使用a和g单质组成的燃料电池,该电池具有高能、轻便和不污染环境等优点。该电池反应为____________________。
分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题: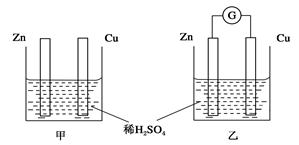
(1)以下叙述中,正确的是__________。
| A.甲中锌片是负极,乙中铜片是正极 |
| B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液pH均增大 |
| D.产生气泡的速度甲中比乙中慢 |
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为__________;乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是__________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式_________________