硫酸的产量是衡量一个国家化工水平的标志。2SO2(g) + O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
| |
甲 |
乙 |
丙 |
|
| 起始物质的量 |
n(SO2) / mol |
0.4 |
0.4 |
0.8 |
| n(O2) / mol |
0.24 |
0.48 |
0.48 |
|
| SO2的平衡转化率 |
80% |
α1 |
α2 |
下列判断中,正确的是
A.甲中反应的平衡常数大于乙
B.平衡时,SO2的转化率:α1<80%<α2
C.该温度下,乙中平衡常数值为400
D.平衡时,丙中c(SO3)是甲中的2倍
下列实验现象以及结论均合理的是
| A.在一块镀锡铁板刻一划痕,滴加酸化的食盐水浸泡及KSCN溶液,溶液颜色没有变化,判断其具有好的耐腐蚀性 |
| B.测定一定物质的量浓度的某NaA溶液的pH,pH>7,可以说明HA是弱酸 |
| C.在氯化银的悬浊液中加入碘化钠溶液,沉淀颜色不变,说明氯化银的溶解度比碘化银大 |
| D.在酸碱中和滴定中,用标准氢氧化钠溶液测定醋酸溶液的浓度时,用甲基橙做指示剂对滴定终点的判断比用酚酞的更准确 |
某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是
A.该反应的化学方程式:3X+Y 2Z 2Z |
| B.反应开始至2min,Z的平均反应速率:0.1mol/(L·min) |
| C.若在3min后,把Z从反应体系中分离,平衡不移动 |
| D.用X表示该化学反应速率比用Y表示的要快 |
下列有关实验的说法正确的是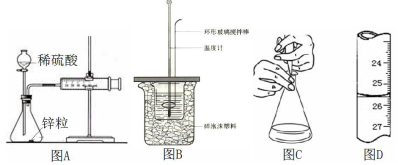
| A.图A中测定锌粒与1 mol/L稀硫酸反应速率,只需测定量筒中收集氢气的体积 |
| B.图B装置中进行50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液测定中和热,使温度计温度升高的热量就是中和反应生成1 mol水的热量 |
| C.图C酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁以减小实验误差 |
| D.图D滴定管中读数为26.50mL |
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
| 选项 |
现象或事实 |
解释 |
| A |
碱性锌锰电池比普通锌锰电池性能好 |
锌在碱性介质中被氧化成更高价态 |
| B |
配制FeCl2溶液时加入少量铁粉 |
抑制Fe2+的水解 |
| C |
施肥时,草木灰(有效成分为K2CO3)不能与铵盐氮肥混合使用 |
它们反应生成氨气会降低肥效 |
| D |
纯水和干木头都不导电,但木头用水浸湿后却可以导电 |
水和干木头的某些成分发生化学反应 |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见右图。下列说法不正确的是
| A.CaSO4溶解在水中,c(Ca2+)=c(SO42-) = 3×10-3mol/L |
| B.在d点溶液中加入一定量的CaCl2可能会有沉淀析出 |
| C.a点对应的Ksp等于c点对应的Ksp |
| D.b点将有沉淀生成,平衡后溶液中c(SO42-)等于3×10-3mol/L |