铝硅合金材料性能优良。铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该铝硅合金的工艺如下: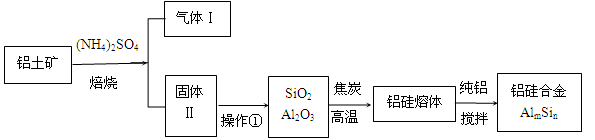
(1)焙烧除铁反应:
4(NH4)2SO4 + Fe2O3  2NH4Fe(SO4)2 + 3H2O + 6NH3↑
2NH4Fe(SO4)2 + 3H2O + 6NH3↑
(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 。指出气体Ⅰ的用途 (任写一种)。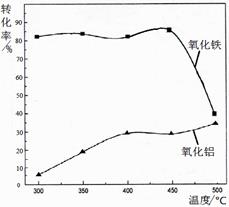
(2)操作①包括:加水溶解、 。若所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为 。
(3)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。任写一个高温下中间体又与Al2O3反应生成铝、硅单质的化学方程式 。
(4)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有 ,假设该溶液中Al3+物质的量浓度为1.0 × 10-3mol/L,如果要将溶液在中的金属阳离子分离,则应控制溶液pH的范围为 (计算结果保留2位有效数字)。
(已知:Ksp[Fe(OH)3] =" 8.0" × 10-38,Ksp[Al(OH)3] =" 1.0" × 10-33,lg5 = 0.7)
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液.制备出之后要冷却为固态才便于操作和贮存。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,铁架台和夹持仪器已略去。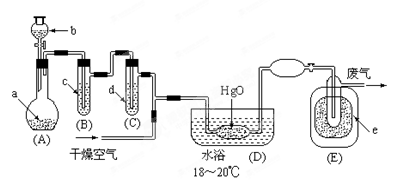
部分物质的有关物理数据如下:
| 化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
| N2 |
-209.86 |
-195.8 |
| O2 |
-218.4 |
-183 |
| CO2 |
-57 |
/ |
| NH3 |
-77.3 |
-33.35 |
| Cl2 |
-101 |
-34.6 |
试回答:
(1)A中盛有深色固体试剂a是,分液漏斗中b试剂是。
(2)B中盛有液体c是 ,C中的液体d是 。
(3)D中发生化学反应的化学方程式是。
(4)E中的保温瓶中盛有致冷剂,它应是(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是 。
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是,用这些不同的连接方式的主要理由是 。
(12分) 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
方案甲:
方案乙: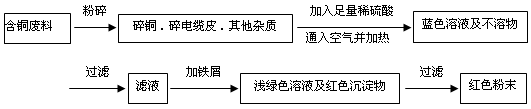
(1)两个方案中,符合当前生产中绿色化学理念的是方案,理由是。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________________,
若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为:︰。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。
通过计算测知该晶体的化学式是。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 =" 2" CuCl ↓+ 3 Na2SO4 + CO2↑
测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:
Fe 3++CuCl=Fe 2++Cu2++Cl-,Ce4+ + Fe 2+ = Fe 3+ + Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
I.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有重要的作用。
下列关于实验的叙述中正确的有。(选填字母)
| A.金属钠着火时,应立即用大量水扑灭 |
| B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH清洗 |
| C.蒸发结晶时应将溶液蒸干后再停止加热 |
| D.蒸馏时,应使温度计水银球伸入液面下 |
E. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
F. 使用容量瓶前检查它是否漏水
G.配制溶液时,定容时俯视刻度线观察液面
H.焰色反应实验时,每做完一次实验,铂丝应先沾上稀盐酸放在火焰上灼烧到无色时,再做下一次实验。
II.某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,采用了不同的实验方法。(装置如下图所示)
(1)根据上图I、Ⅱ所示实验,能够达到实验目的的是(选填装置序号)。
(2)图III所示实验能够鉴别碳酸钠和碳酸氢钠这两种物质,请写出试管C中发生反应的化学方程式。
(3)图Ⅳ不仅能鉴别碳酸钠和碳酸氢钠,同时又能验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的物质为,实验过程中的现象为。
四只未贴标签的试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,通过下列实验将四种溶液分别检出,请按实验步骤回答下列问题。
在四支试管中分别取四种溶液各1mL,完成下列实验。
(1)在四支试管中分别滴入,出现现象的是,离子反应方程式是 。
。
(2)在剩余三支试管中分别滴入,出现现象的是,离子反应方程式是。
(3)在剩余两支试管中分别滴入 ,出现现象的是, 离子反应方程式是。三次实验中都没有明显现象的是。
,出现现象的是, 离子反应方程式是。三次实验中都没有明显现象的是。
用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释、降温;④转移、洗涤;⑤定容、摇匀。回答下列问题
(1)所需浓硫酸的体积是 ;
;
(2)第⑤步实验的具体操作是 。
。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.容量瓶用蒸馏洗涤后残留有少量的水
B.所用过的烧杯、玻璃棒未洗涤
C.定容时俯视溶液的液面