目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
I.甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g) + H2O(g)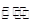 CO(g) + 3H2(g)
CO(g) + 3H2(g)
(1)阅读下图,计算该反应的反应热ΔH = _______________kJ/mol。
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为______________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为____________________,各离子浓度由大到小的顺序为________________________________________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s)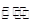 5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = _________________________。
(6)下列说法不正确的是____________________(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
IV.(7)电解CO制备CH4和W,工作原理如图所示,其原理用电解总离子方程式解释是_____________。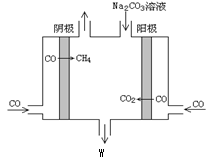
某实验小组利用饱和食盐水、导线、直流电源(用“ ” 或“
” 或“ ”表示)、烧杯、灵
”表示)、烧杯、灵
敏电流计(用“ ”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
甲同学安装好仪器,接好直流电源通电几分钟,发现M处溶液逐渐变浅绿色,过一段时间,溶液变得浑浊且逐渐出现红棕色。
乙同学所用的仪器和甲同学的看上去相同,但接好直流电源通电几秒钟,却闻到一股刺鼻的气味,马上停止通电。
丙同学安装好仪器,线路闭合几秒钟后,却没有发现明显现象产生,他又很快接入灵敏电流计,发现电流计的指针发生了偏转。
请根据上述同学的实验现 象回答以下问题:
象回答以下问题:
(1)M电极棒材料是(写化学式),N电极棒材料是(写化学式)。
(2)在下列虚框内完成对应三个同学的装置图: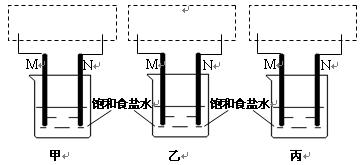
(3)按要求写出三个同学实验过程中涉及的反应方程式:
甲同学N电极方程式
乙同学总反应的离子方程式
丙同学N电极方程式
(4)用化学方程式解释甲同学实验时观察到M处溶液出现浑浊后转为红棕色现象的原因: 。
。
(5)丙同学为了保护M电极不被腐蚀,他可以将N电极棒更换为(写化学式)。为验证该防护方法有效,他又做下列对比实验:接通电路2分钟后,分别在M电极区滴入2滴黄色K3[Fe(CN)6]溶液,发现没有更换N电极棒的烧杯中的现象是。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题: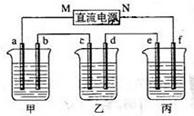
(1)电源的N端为极;
(2)写出电解前后各溶液的pH变化情况(增大、减小或不变 ):
):
甲溶液;乙溶液;丙溶液;
(3)电极b上生成的气体在标准状态下的体积是;
电极c的质量变化是g。
(19分)有机物W(C3H6O3)能与NaHCO3反应,分子中含有四种活动性不同的氢原子,个数比为3:1:1:l。
(1)W的结构简式是。
(2)W的工业合成路线如下图所示:
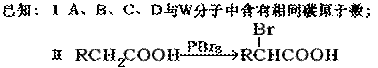
①写出A的结构简式是。
②B与新制Cu(OH)2悬浊液反应的化学方程式是。
③D在NaOH水溶液中反应的化学方程式是
____________________________________________________________。
(3)工业也可以用下图所示合成路线生产W: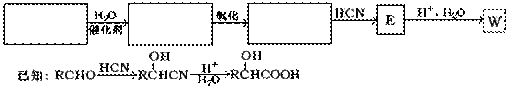
请在合成路线框图中填入相应有机物的结构筒式。
(4)①W在一定条件下,反应生成丙交酯(C6H8O4),该反应的化学方程式是(有机物写结构简式)。
②丙交酯在一定条件下聚合生成聚丙交酯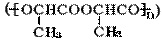 ,聚丙交酯经抽丝可制成手术缝合线,在人体内可自动缓慢降解为W。聚丙交酯在体内降解的化学方程式是。
,聚丙交酯经抽丝可制成手术缝合线,在人体内可自动缓慢降解为W。聚丙交酯在体内降解的化学方程式是。
(1)下列事实中,能证明亚硫酸的酸性强于氢硫酸的是 (填字母)。
a.亚硫酸受热时易分解
b.相同条件下,等浓度的亚硫酸溶液导电能力强于氢硫酸
c.亚硫酸溶液可使品红溶液褪色,而氢硫酸不能
d.常温下,浓度均为0.1mol/L的H 2SO 3溶液和H 2S溶液的pH分别是2.1和4.5
(2)工业上除去高压锅用水中溶解的氧气常用的试剂有Na 2SO 3和N 2H 4(肼)。
①已知16g液态的肼与氧气反应得到氮气和液态水时,放热354.87kJ,该反应的热化学方程式是 。
②除去等质量的O 2,所耗Na 2SO 3和N 2H 4的质量比是 (填最简整数比)。
(3)向Na 2SO 3和Na 2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀。则该反应中氧化剂和还原剂的物质的量之比是 。
(4)已知Na 2SO 3在高温下发生分解,得到两种产物。某同学称取25.2g纯净的Na 2SO 3·7H 2O晶体在高温下隔绝空气加热至恒重,冷却后称得固体为12.6g,将其完全溶于水配成1L溶液,并测溶液的pH。
①Na 2SO 3高温分解的化学方程式是 。
②测得溶液的pH大于0.025mol/LNa 2SO 3溶液的pH,试解释原因(结合离子方程式说明) 。
阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是(填序号)
| A.氢 | B.碳 | C.氧 | D.硫 |
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有一种是铝元素?为什么?
;。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为 。
。
信息⑤:上述四种元素中,X与W同主族。
(5)X与浓硫酸反应的化学方程式为。