【化学—选修2:化学与技术】化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。氮的化合物是重要的化工原料,在工农业生产中有很多重要应用。工业上合成氨的流程示意图如下:
回答下列问题:
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol。在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是___________________________________________________________。
2NH3(g) ΔH=-92.4kJ/mol。在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是___________________________________________________________。
(2)原料氢气的来源是水和碳氢化合物,写出工业生产中分别采用煤和天然气为原料制取氢气的化学反应方程式:___________________________, 。
(3)设备B的名称________________,其中m和n是两个通水口,入水口是 (填“m”或“n”),不宜从相反方向通水的原因_________________________________。
(4)设备C的作用是____________________________________________________。
(5)为了提高其产量,降低能耗,近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是_________________________________________________________________________________;
与传统的合成氨的方法比较,该方法的优点是________________________________________。
元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
(1)上表中与A属于同一周期的元素是(填元素名称),写出D离子结构示意图。
(2)D和B形成的化合物的化学式为。
写出A单质与水反应的离子方程式。
(3)对B、C的单质或化合物描述正确的是。
a.C元素的最高正价为+7b.常温、常压下C单质性质稳定
c.B的氧化物只有两种d.C单质分子中含有18个电子
(4)从海水中提取D的单质可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④电解得到产物。以上提取D的单质的过程中,没有涉及的化学反应类型是
a.分解反应 b.化合反应 c.复分解反应d.置换反应
在①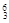 Li 、②
Li 、②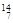 N 、③
N 、③ Na 、④
Na 、④ Mg 、⑤
Mg 、⑤ Li 、⑥
Li 、⑥ C 、⑦C60 、⑧石墨中,选择序号填空。
C 、⑦C60 、⑧石墨中,选择序号填空。
(1)和质量数相等,但不能互称同位素;
(2)和的中子数相等,但质子数不相等,所以不是同一种元素;
(3)和互为同素异形体。
工业上用铬铁矿(主要成分FeO·Cr2O3,杂质为SiO2、Al2O3等)
生产重铬酸钾(化学式K2Cr2O7,)的流程如下: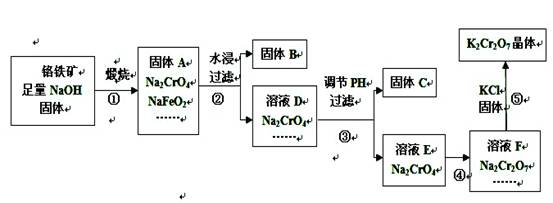
(1)固体A中,除Na2CrO4、NaFeO2、NaOH外还有等;
(2)固体A水浸时,NaFeO2会发生强烈水解产生固体B,其化学反应方程
式为;
(3)固体C中含有2种物质,要先加入下列物质中的,然后才
能进行过滤分离。
A.氢氧化钠溶液B.稀氨水C.稀盐酸
(4)步骤④加入盐酸得到的溶液F中,除Na2 Cr2O7外,还含有的溶质
是;
(5)在上述流程中,有氧化还原反应发生的是第____步。
(6)已知20℃时K2Cr2O7饱和溶液浓度为0.4 mol·L-1,步骤⑤中加入固
体氯化钾,若使K+离子浓度达到4 mol·L-1(保持温度20℃),则溶液F中Cr2O72-离子的浓度最大为。
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_____ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用__________________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果______(填“偏大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_________________________________;判断到达滴定终点的依据是:______________________________________________________________。
(4)以下是实验数据记录表
| 滴定次数 |
盐酸体积(mL) |
NaOH溶液体积读数(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.00 |
18.10 |
| 2 |
20.00 |
0.00 |
16.04 |
| 3 |
20.00 |
0.20 |
16.28 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,
其可能的原因是( )
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为: ________mol·L-1
.(12分) 现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产
生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性;常温下,0.1 mol/L
B溶液的pH大于13,0.1 mol/L C溶液的pH等于1
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有
气体产生;(沉淀包括难溶物和微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)写出A、B、C、D、E的化学式:A、B、
C、D、E
(2)写出A、E溶液反应的离子方程式:
。
(3)写出B溶液与C溶液恰好完全反应的离子方程式:
_____。
(4)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由小到大的顺序为(带两个单位电荷的离子不参与比较):__________________________________。