选做[化学—一选修2:化学与技术](15分) 以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)沸腾炉中发生反应的化学方程式为 。
(2)接触室中发生如下反应:2 SO2(g)+O2(g) 2SO3(g) △H=一196.6 kJ·mol-1某研究小组模拟工业生产,在实验室中研究了其他条件不变时,改变某一条件对上述反应的影响.下列分析正确的是 。
2SO3(g) △H=一196.6 kJ·mol-1某研究小组模拟工业生产,在实验室中研究了其他条件不变时,改变某一条件对上述反应的影响.下列分析正确的是 。
a.图I研究的是t0时刻增大O2的浓度对反应速率的影响
b.图Ⅱ研究的是t0时刻加入催化剂对反应速率的影响
c.图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
d.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
(3)已知:SO3(g)+H2O(1)=H2SO4(1) ΔH=一130.3 kJ·mol-1。当有6.72×104L(已折算为标准状况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(4)依据工艺流程图判断下列说法正确的是 (选填序号字母)。
a.沸腾炉排出的矿渣可供炼铁
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.为使黄铁矿充分燃烧,需将其粉碎
(5)吸收塔吸收SO3用98.3%浓硫酸的原因是 。
(6)某硫酸厂为测定接触室所得气体中S02的体积分数,取280 mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:Cr2O72-+Fe2++H+→Fe3++H2O十Cr3+(未配平)
①SO2通入Fe2(SO4)3溶液中发生反应的离子方程式为 。
②接触室所得气体中SO2的体积分数为 。
香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去):
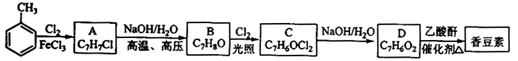
已知一下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子连有两个羟基通常不稳定,易脱水形羰基。
请回答下列问题:
(1)香豆素的分子式为_____________________;
(2)由甲苯生产A的反应类型为__________________,A的化学名称为__________________;
(3)由B生产C的化学反应方程式为_______________________________________________;
(4)B的同分异构体中含有苯环的还有______________________种,其中在核磁共振氢谱中
只出现四组峰的有________________种;
(5)D的同分异构体中含有苯环的还有______________________种, 其中:
其中:
①既能发生银镜反应,又能发生水解反应的是________________________(写结构简式);
②能够与饱和碳酸氢钠溶液反应放出CO2的是_______________________(写结构简式)。
某有机物A由C、H、O、N四种元素组成,质量分数分别为C:54.8%,H:5.58%,N:7.11%,其余为O,A的相对分子质量不超过300。A是—氨基酸,并且分子中-NH2和-COOH连在同一个碳原子上,分子中不存在甲基(-CH3),能与FeCl3溶液发生显色反应,1mol A的溶液能与3mol NaOH完全反应。请回答:
(1)有机物A的相对分子质量为,其分子式为。
(2)符合上述条件的有机物A的结构有种,写出其中的三种结构简式:
_________ ____________ 、_______________________、________________________。
____________ 、_______________________、________________________。
“立方烷”是新合成的一种烃,其分子为正立方体结构,其结构如图所示:
(1) 立方烷的分子式为_____________________________________ 。
(2) 其二氯代物共有________________________种同分异构体。
(3) 与立方烷互为同分异构体的芳香烃的结构简式为_________________________________ 。这种芳香烃异构体与单体_______________________________(写结构式)可合成具有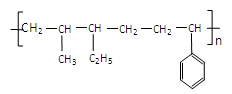 结构的橡胶。
结构的橡胶。
(4) 苯乙炔可用这种芳香烃异构体为起始物质,通过加成、消去反应制得。写出制取苯乙炔的化学方程式(所需的无机试剂自选)。
______________________________________,________________________________ _____
_____
乙偶姻是一种重要的香料。已知 乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
请按要求回答下列问题:
Ⅰ.(1)乙偶姻的分子式为___________________。
(2)X是乙偶姻的同分异构体,且X属于酯类,其结构简式可能有__________种,
请写出X的一种结构简式:_________________________________________。
Ⅱ.与乙偶姻有关的反应如下:
(3)乙偶姻除含有碳氧双键外,还含有的官能团名称是____________________;
写出①、④的反应类型:① ___________、④ ___________;G的名称____________。
(4)A核磁共振氢谱仅有一种类型氢原子的吸收峰,其结构简 式是______________。
式是______________。
(5)写出②、③的化学反应方程式:
②________________________________________________________________ _____;
_____;
③_____________________________________________________________________;
(6)设计实验检验F中的官能团:
操作方法: ;
;
现象:
 ;
;
结论:。
Ⅰ.食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯(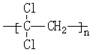 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由____________________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由____________________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4CH=CHCH2CH=C H(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是____________________________(填序号)。
H(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是____________________________(填序号)。
A.分子式为C18H34O2
B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应
D.不能使酸性KMnO4溶液褪色
Ⅱ.香精(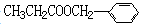 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下。
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下。
已知:A具有两种一氯代物B和C。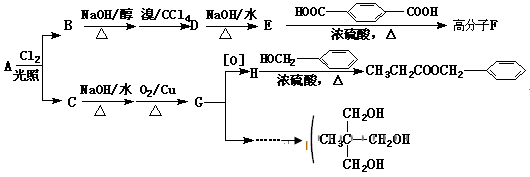
回答下列问题:
(1)和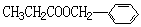 互为同分异构体的是____________________ (填序号)。
互为同分异构体的是____________________ (填序号)。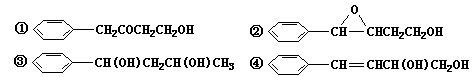
(2)D物质的名称为______________________________。
(3)高分子F的结构简式为___________ ___________________;
___________________;
(4)写出H和I反应生成三酯的化学方程式:______________________________。