已知X、Y、Z是阳离子,K是阴离子,M、N是分子.它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀J生成,再加入过量的含K或Y的溶液,沉淀J消失.
回答下列问题:
(1)Y的化学式为 ;N的电子式为 ;
(2)试比较M和N的稳定性:M N(填“>”或“<”).
(3)写出Z和N的水溶液反应的离子方程式: ;
(4)从电离的角度看白色沉淀J能溶于过量的含K或Y的溶液其原因是(用离子方程式表示):
(5)上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1mol/L的NaOH溶液,出现了如图中a、b、c三个阶段的图像,①写出b阶段的离子方程式: .
②根据图像判断该盐的化学式为 .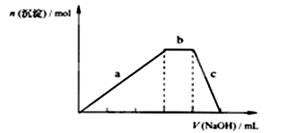
(5分)某有机物0.30 g在足量O2中完全燃烧,只生成224 mL(标准状况)CO2和180 mg H2O.试回答下列问题:
(1)该有机物的实验式为_____________.
(2)若该有机物的实验式就是其分子式,则它的电子式是________
(3)若A是易挥发有水果香味的液体,能发生水解反应,则其结构简式为:___________。
(4)若该有机物的相对分子质量为90,分子中有一个连有4个不同原子或原子团的碳原子,分子间能发生酯化反应,则它的结构简式是_______ _.
(5)若该有机物是蔗糖的水解产物,相对分子质量为180,具有多元醇和醛基的性质,则其结构简式为____________。
下图是从苯酚的乙醇溶液中分离回收苯酚的操作流程图:

根据图示完成下列 问题:
问题:
(1)试剂A的化学式为 ______________.
______________.
(2)步骤③的操作名称为________________.
(3)写出C+D―→E+C6H5OH的化学方程式:____________________________ _______.
_______.
(8分)在一体积为1 L的容器中,通入一定量的N2 O4,在100℃时发生如下反应:
(1)在0-60s这段时间内,以N2O4表示的平均反应速率为mol·L-1·s-1
(2)上述反应的平衡常数表达式为,升高温度K值(填“增大"、“减小”或“不变”)
(3)反应进行到100s时,若有一项条件发生变化,变化的条件不可能是(填选项序号)。
| A.降低温度 | B.通人氦气使其压强增大 | C.又往容器中充入N2O4 | D.使用催化剂 |
(4分)已知:C(s)+O2(g)  CO2(g)ΔH="-437.3" kJ·mol一1
CO2(g)ΔH="-437.3" kJ·mol一1
H2(g)+ O2(g)
O2(g)  H2O(g)ΔH ="-285.8" kJ·mol一1
H2O(g)ΔH ="-285.8" kJ·mol一1
CO(g)+ O2(g)
O2(g)  CO2(g)ΔH ="-283.0" kJ·mol一1
CO2(g)ΔH ="-283.0" kJ·mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是
(8分)四种短周期非金属元素A、B、C、D,原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是。
(2)化合物CA3的电子式是,BD2分子的结构式为。
(3)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为。