有关资料介绍,制取氧气有多种方法,其中氧化铜与氯酸钾混合加热,也能很快产生氧气。现将2.5g氧化铜与24.5g氯酸钾的混合物充分加热,残余固体经冷却、称量、质量为17.4g。然后将固体溶于65.1 g水中,充分搅拌,过滤得到滤液和黑色的滤渣。滤渣又经过洗涤、烘干、称量,质量为2.5g。(不考虑过程中物质的损失,计算结果保留一位小数)
(1)该反应中氧化铜起
(2)生成的氧气为
(3)所得滤液中溶质是
(4)向所得滤液中加入质量分数为16%的
溶液恰好完全反应,需
溶液的质量为多少克?(列出必要的计算过程)
小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量。现取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。技术员提示小明:氯化钙与碳酸钠反应的化学方程式:CaCl2+Na2CO3 =CaCO3↓+2NaCl。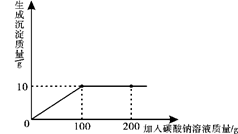
求:(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是g。
(2)样品中氯化钠的质量是多少?
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
小苏打(主要成分为NaHCO3)中常含有少量氯化钠。化学兴趣小组的同学为了测定某品牌小苏打中NaHCO3的质量分数。进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如下表所示。
| 物质 |
样品 |
消耗稀盐酸质量 |
反应后溶液质量 |
| 质量(g) |
9 |
75.4 |
80 |
试计算:(计算结果保留一位小数)
(1)样品中的NaHCO3质量分数;
(2)所得溶液中NaCl的质量分数。
下列五种溶液:①NaOH 溶液、 ②Ba(OH)2溶液、③Na2SO4溶液、④稀硝酸、⑤混有少量硝酸的MgSO4溶液
(1)指出其中属于碱溶液的(选填序号);
(2)若将Ba(OH)2溶液与Na2SO4溶液混合,产生沉淀质量是116.5克.需要20%的硫酸钠溶液多少克?
(3)若将Ba(0H)2溶液逐滴加人到混有少量硝酸的MgSO4溶液中,所得沉淀的质量与加入的
Ba(OH)2的质量变化符合下列图像的是(选填序号)·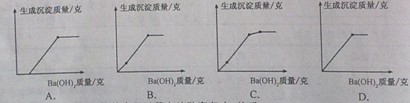
一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。化学课外兴趣小组的同学决定测定该瓶试剂变质的程度,他们在知识回顾的基础上,依次进行了如下的实验操作:
知识回顾:氢氧化钠必须密封保存;氢氧化钠与二氧化碳反应生成Na2CO3和H2O;CaCO3不溶于水。
第一步:取该瓶中的试剂20g加水配制成溶液;
第二步:向上述溶液中加入足量的澄清石灰水;
第三步:过滤、干燥、称量,生成沉淀为5g。
(1)若该瓶试剂中的Na2CO3的质量分数为A,则氢氧化钠的质量分数 1-A(填大于、等于或小于),原因是 。
(2)计算该20g试剂中含有杂质Na2CO3的质量分数(结果精确到0.1%)。
已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,为了测定产品中碳酸氢钠的质量分数,具体的检验步骤如下:
①取一只洁净的坩埚,称其质量为a g;再向其中加入样品。称得总质量为m1 g;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为m2 g。
(1)写出碳酸氢钠受热分解的化学方程式▲。
(2)用▲(填仪器名称)将加热后的坩埚放到▲中(填序号)冷却。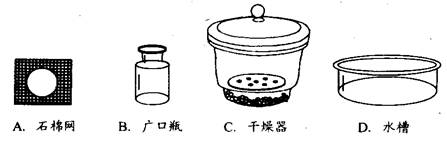
(3)根据题意,用a、m1、m2的代数式表示样品中碳酸氢钠的质量分数为。
(4)步骤①、③和④都需要用到精度为0.1g的托盘天平称量,若本题中(m1-m2)的值超过0.6g,假设样品中碳酸氢钠的质量分数为90%,则至少需称样品多少克?