氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2 kJ,形成1 mol 氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是
| A.Q1+Q2>Q3 | B.Q1+Q2>2Q3 | C.Q1+Q2<Q3 | D.Q1+Q2<2Q3 |
常温下,有下列4种溶液,下列说法正确的是()
| ① |
② |
③ |
④ |
| 0.1 mol·L-1 CH3COOH溶液 |
pH=3 CH3COOH溶液 |
0.1 mol NaOH溶液·L-1 |
pH=11 NaOH溶液 |
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍后,pH与②相同
C.①与③混合,若溶液pH=7,则两种溶液的体积:③>①
D.②与④混合,若溶液pH=7,则两种溶液的体积:④>②
已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中,正确的是()
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
| 实验编号 |
c(HA)/ mol·L-1 |
c(NaOH)/ mol·L-1 |
反应后溶液pH |
| 甲 |
0.1 |
0.1 |
pH=9 |
| 乙 |
c1 |
0.2 |
pH=7 |
下列判断不正确的是()
A.c1一定大于0.2 mol·L-1
B.HA的电离方程式是HA H++A-
H++A-
C.甲反应后溶液中:c(Na+) >c(OH-) >c(A-) >c(H+)
D.乙反应后溶液中:c(Na+) <c(HA)+c(A-)
工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是()
CuS(s)+Mn2+(aq),下列说法错误的是()
| A.该反应达平衡时[Mn2+]=[Cu2+] |
| B.MnS的Ksp比CuS的Ksp大 |
| C.往平衡体系中加入少量CuSO4固体后,[Mn2+]变大 |
D.该反应的平衡常数K=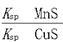 |
下列说法正确的是()
| A.食盐溶液中除去SO42-最合适的试剂是Ba(NO3)2 |
| B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| C.25 ℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| D.AgCl易转化为AgI沉淀且Ksp(AgX)=[Ag+]·[X-],故Ksp(AgI)<Ksp(AgCl) |