(15分)
Ⅰ.下列实验设计或操作合理的是________。
A.在催化剂存在的条件下,苯和浓溴水发生反应可生成无色比水重的液体溴苯
B.只用水就能鉴别苯、硝基苯、乙醇
C.实验室制取乙烯时需要控制温度在170℃左右,因此使用水浴加热
D.将10滴溴乙烷加入1mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
E.工业酒精制取无水酒精时先加生石灰然后蒸馏,蒸馏必须将温度计的水银球插入反应液中
F.苯酚中滴加少量的稀溴水,可用来定量检验苯酚
G.将铜片放入盛有无水乙醇的试管中加热,完成乙醇氧化为乙醛的实验
H.为了减缓电石和水的反应速率,可用饱和食盐水来代替水进行实验
Ⅱ.某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯( ),已知有关物质的沸点如下表:
),已知有关物质的沸点如下表:
| 物质 |
异丙醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
82.4 |
249 |
218 |
合成苯甲酸异丙酯粗产品在如图圆底烧瓶中加入12.2 g苯甲酸和30 mL异丙醇(密度约为0.79 g·cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热30分钟,使反应完全,得苯甲酸异丙酯粗产品。
(1)仪器A的名称是 ;加入碎瓷片的目的是 ;
(2)异丙醇的系统命名法的名称为 ;浓硫酸的作用是_____________;
(3)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式________________。
粗产品的精制
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要仪器是 ;操作②的名称是__________
(5)通过计算,苯甲酸甲酯的产率为__________________
(6)该实验中不能用于提高苯甲酸甲酯的产率的措施是__________
A.苯甲酸的质量由12.2g增加至24.4g
B.30ml的异丙醇增加至35mL
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用是;若用含同位素18O的乙醇分子与乙酸反应,写出能表示18O位置的化学方程式:。
(2)球形干燥管C的作用是。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示);反应结束后D中的现象是.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;再加入(此空从下列选项中选择),然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.无水硫酸钠 B.碱石灰
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:________。 |
| (2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 |
(2)A的分子式为:________。 |
| (3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 |
(3)写出A中含有的官能团:________、________。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有______种氢原子 |
| (5)综上所述A的结构简式____________________。 |
(Ⅰ)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
(1)写出溴乙烷在NaOH水溶液中的反应方程式:
反应类型。某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:。
(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式反应类型。反应中生成的气体可以用下图所示装置检验,现象是,水的作用是。除高锰酸钾酸性溶液外,还可以用检验生成的气体,此时还有必要将气体先通入水中吗?(填“有”或“没有”) 
(Ⅱ)下面是实验室制乙烯并检验其性质的装置图,请回答:
(1)写出圆底烧瓶中反应的方程式,
反应类型_______________;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:
;
(3)为了检验乙烯的生成,试管中应盛放,
现象为;
(4)洗瓶中盛放的试剂为,作用________________________________。
(Ⅲ)某学习小组同学为了确定盐酸 、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验:
(1)锥形瓶内装某可溶性盐,写出A中反应的离子方程式:
;
(2)C中的现象为,写出C中反应的化学方程式:_____________;
(3)B中的试剂为,作用。
(I) 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1) 写出该反应的化学方程式。
(2) 检验溶液中Fe3+存在的试剂是,证明Fe3+存在的现象是。
(Ⅱ) 印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。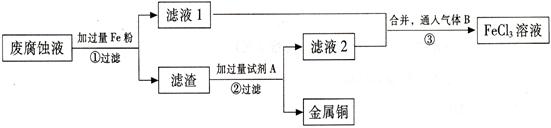
⑴ 步骤①中发生反应的离子方程式。
(2) 步骤②需加入的试剂A是(填化学式)。
(3) 步骤③通入的气体B是(填化学式),写出该反应的化学方程式。
(4) 为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),试计算滤渣中铜的质量分数。
混合物A中含有KAl(SO4)2·12H2O、Al2O3和Fe2O3,通过下图所示方法可分离回收Al2O3和Fe2O3:
回答下列问题:
(1) 滤渣Ⅰ的主要成分是(填化学式)。
(2) 为了使滤渣Ⅰ中某些成分溶解,便于分离出Fe2O3,所加入的试剂Ⅰ是(填化学式),发生反应的离子方程式是:。
(3) 向滤液Ⅰ中加入过量氨水可得到白色沉淀,反应的离子方程式是:。
(4) 滤渣Ⅲ的主要成分是(填化学式);滤渣Ⅲ在一定条件下反应生成 Al2O3,反应的化学方程式是。