现有纯锌片、纯铜片和500 mL 0.1 mol·L-1的硫酸、导线、1 000 mL量筒。用如下图所示装置利用原电池原理,制备一定量的氢气。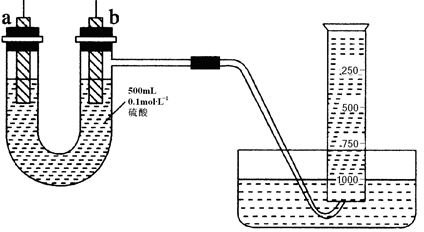
(1)如上图所示,装置气密性良好,且1 000 mL量筒中已充满水,刚开始实验时,根据构成原电池必须满足的条件,首先要进行的操作是 ;
(2)a的电极材料为 ,作原电池的 极;电子经外电路由
(①a→b ②b→a 填序号,下同)
(3)b极上发生的电极反应为_________,反应时a极附近SO42-浓度 (填“逐渐增大”、“逐渐减小”或“始终不变”);
(4)假设反应过程中溶液体积不变,当硫酸浓度降低一半时,通过导线的电子的物质的量为 ,量筒中收集的气体体积最接近 mL
| A.400 | B.500 | C.600 | D.700 |
下表是元素周期表的一部分,回答下列有关问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)写出下列元素符号:①,⑦。
(2)画出原子的结构示意图:④,⑧;
(3)在①~⑨元素中,原子半径最大的是(除稀有气体外),非金属性最强的元素是,最不活泼的元素是。(均填元素名称)
(4)在①~⑨元素中的氢氧化物碱性最强的是;元素⑥、⑦、⑧的氢化物稳定性最弱的是(均用化学式填空)
(5)第三周期中有一种元素,其最高价氧化物的水化物具有两性,用离子方程式表示该水化物分别与稀硫酸和烧碱溶液的反应:
与稀硫酸反应:;
与烧碱溶液反应:。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”、“向右”或“不”);使用催化剂反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”、“向右”或“不”);使用催化剂反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-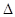 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)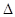 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)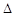 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的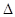 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。
(3)已知:2NO2(g) N2O4(g)△H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g)
N2O4(g)△H=-57.2kJ·mol-1。一定温度下,一定体积的密闭容器中充入NO2进行反应:2NO2(g) N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变);
N2O4(g)达到平衡。写出该反应的平衡常数表达式: ,升高温度,该反应的平衡常数K值将 (填增大或减小或不变); 若其他条件不变时,下列措施能提高NO2转化率的是(填字母序号)
若其他条件不变时,下列措施能提高NO2转化率的是(填字母序号)
| A.减小NO2的浓度 | B.降低温度 | C.增加NO2的物质的量 | D.升高温度 |
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=。
有可逆反应A+B 2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图所示,那么:
2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图所示,那么: (1)反应在___________________温度下达到化学平衡;
(1)反应在___________________温度下达到化学平衡;
(2)此正反应为______________________热反应;
(3)由T1向T2变化时,V正____________V逆(填>、<、=);
(4)由T3向T4变化时,V正_____________V逆(填>、<、=).
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题: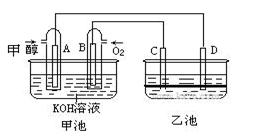
(1)通入甲醇的惰性电极的电极反应式为。若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为。
(2)在乙池反应过程中,可以观察到电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色, C极发生的电极反应式为。
某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: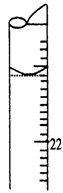
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
|
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。
回答下列问题: