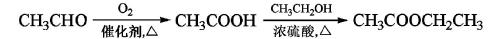A、B、C属于周期表前4周期的元素,它们的原子序数依次增大。A、B属于同一周期,C是生活中常见的金属元素。A的氧化物是沙子的主要成分,B的单质常温下为黄色粉末。
(1)C在周期表中位于___________周期____________族。
(2)在加热条件下B单质与C单质反应的化学方程式是_____________________________。
(3)A的氧化物用NaOH溶液处理,使A元素变为可溶性盐,该反应的离子方程式是____________。
(4)B与C形成的化合物CB2,在有水存在的条件下用氧气氧化该化合物,得到强酸性溶液和低价盐,该氧化还原反应的化学方程式是_____________________________________。
【2015新课标Ⅰ卷理综化学】[化学——选修5:有机化学基础]A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示: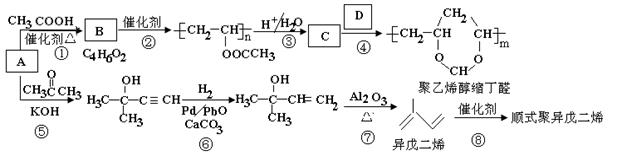
回答下列问题:
(1)A的名称是 ,B含有的官能团是 。
(2)①的反应类型是 ,⑦的反应类型是 。
(3)C和D的结构简式分别为 、 。
(4)异戊二烯分子中最多有 个原子共平面,顺式聚异戊二烯的结构简式为 。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体 (填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线 。
【2015海南化学】[选修5—有机化学基础]下列有机物的命名错误的是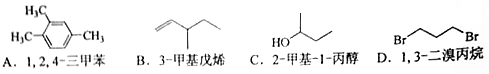
18—Ⅱ芳香族化合物A可进行如下转化: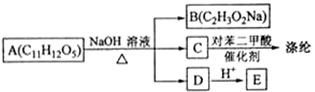
回答下列问题:
(1)B的化学名称为 。
(2)由C合成涤纶的化学方程式为 。
(3)E的苯环上一氯代物仅有两种,E的结构简式为 。
(4)写出A所有可能的结构简式 。
(5)写出符合下列条件的E的同分异构体的结构简式 。
①核磁共振氢谱显示苯环上仅有两种氢②可发生银镜反应和水解反应
【2015上海化学】(本题共12分)
局部麻醉药普鲁卡因E(结构简式为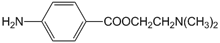 )的三条合成路线如下图所示(部分反应试剂和条件已省略):
)的三条合成路线如下图所示(部分反应试剂和条件已省略):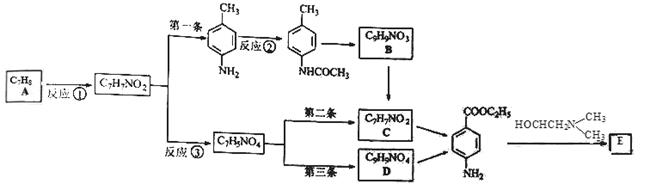
完成下列填空:
(1)比A多一个碳原子,且一溴代物只有3种的A的同系物的名称是 。
(2)写出反应试剂和反应条件。反应① ;③
(3)设计反应②的目的是 。
(4)B的结构简式为 ;C的名称是 。
(5)写出一种满足下列条件的D的同分异构体的结构简式。
①芳香族化合物
②能发生水解反应
③有3种不同环境的氢原子
1 mol该物质与NaOH溶液共热最多消耗 mol NaOH。
(6)普鲁卡因的三条合成路线中,第一条合成路线与第二条、第三条相比不太理想,理由是 。
【2015上海化学】(本题共10分)
对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。
完成下列填空:
(1)写出该共聚物的结构简式
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体 。
。
写出该两步反应所需的试剂及条件。
(3)将 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。
A的结构简式为 。
由上述反应可推知 。
由A生成对溴苯乙烯的反应条件为 。
(4)丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面。
写出B的结构简式。
设计一条由2,3-二甲基-1-丁烯制备B的合成路线。
(合成路线常用的表示方式为: )
)
【2015江苏化学】化合物F是一种抗心肌缺血药物的中间体,可以通过以下方法合成:
(1)化合物A中的含氧官能团为_________和___________(填官能团的名称)。
(2)化合物B的结构简式为________;由C→D的反应类型是:_______。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_________。
Ⅰ.分子含有2个苯环 Ⅱ.分子中含有3种不同化学环境的氢
(4)已知: ,请写出以
,请写出以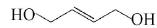 为原料制备化合物X(结构简式
为原料制备化合物X(结构简式 )的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下: