化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
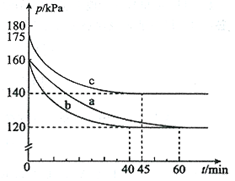
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 ;实验a和c的平衡转化率:αa为 、αc为 。
硫酸铅广泛应用于制造蓄电池。利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下: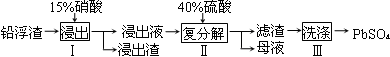
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9×10-5,Ksp(PbSO4)=1.6×10-8。
(1)已知步骤Ⅰ有NO产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的离子方程式、。
(2)步骤Ⅰ需控制硝酸的用量并使Pb稍有剩余,目的是。
(3)母液可循环利用于步骤Ⅰ,其溶质主要是(填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为。
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ·mol-1①
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g)△H2=-1160 kJ·mol-1②
甲烷直接将NO2还原为N2的热化学方程式为。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3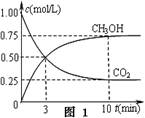
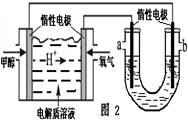
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡(填“正向”、“逆向”或“不”)移动。
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL 某NaCl溶液,正极反应式为。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为mol。
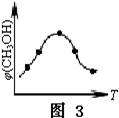
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H30(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是(用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)c(NH3·H2O)。(填“>”、“<”或“=”)
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
8.0 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是。
为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为。
为控制上述PH范围可选择加入的试剂或药品是。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是。“操作A”的名称是。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于。
合成肉桂酸异戊酯G(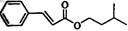 )的路线如下:
)的路线如下: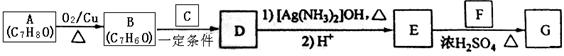
友情提示:
①B和C含有相同的官能团且C在标准状况下的气体密度为1.964g/L;
② 。
。
回答下列问题:
(1)A的结构简式为,D中含有的官能团的名称是;
(2)下列物质在一定条件下能与F反应的是(填标号);
A.溴水B.酸性KMnO4溶液 C.乙酸D.新制氢氧化铜的悬浊液
(3)B和C反应生成D的化学方程式为。
(4)E和F反应生成G的化学方程式为,反应类型为。(各2分)
(5)A的同分异构体中含有苯环的共有种(不考虑立体异构且包括A),其中与氯化铁不能发生显色反应且核磁共振氢谱有四组峰,峰面积之比为3:2:2:1的为______(写结构简式)。(各2分)
现有A、B、C、D、E五种化合物,已知它们的阳离子有Al3+、Fe2+、K+、Ba2+、Ag+,阴离子有SO42-、Cl-、CO32-、NO3-、OH-现将它们分别配成0.1mol/L的溶液进行如下实验:
①测得C和E溶液显碱性,且碱性E>C
②A与C溶液混合后有白色沉淀和无色无味的气体生成,继续加入E溶液后溶液变澄清
③A溶液中加入D溶液后也出现白色沉淀,该沉淀不溶于稀硝酸
④B溶液中加入E溶液出现白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色
根据以上实验,回答下列问题:
(1)写出五种物质的化学式
A, B, C, D, E 。
(2)按要求写出下列反应的反应方程式:
A与C 反应的离子方程式:。
A中加入过量的E溶液后的离子方程式。
B与E反应后的白色沉淀在空气中最终变成红褐色的化学方程式:。