金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca。
(1)Ca的原子结构示意图 。
(2)配平用钙线氧脱鳞的化学方程式:
P + FeO + CaO  Ca3(PO4)2 + Fe
Ca3(PO4)2 + Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n。则金属M为_________,检测Mn+ 的方法是_____________________(用离子方程式表达)。
(4)取1.6g钙线试样,与水充分反应,生成224ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3 g。
(5)处理炼钢厂含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:CO(g) + 1/2 O2(g) ="=" CO2(g)  H = -283.0 kJ·mol-2
H = -283.0 kJ·mol-2
S(s) + O2(g) ="=" YO2(g)  H = -296.0 kJ·mol-1
H = -296.0 kJ·mol-1
此反应的热化学方程式是 。
计算以下两小题时,除必须应用所有给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示),并列出计算式。
(1)在温度为t℃和压强pPa的情况下,19.5g A与11.0g B恰好完全反应,生成固体C和3.00L的D气体,计算生成的C的质量(m)。缺少的数据是,
计算式为m=。
(2)0.48g金属镁与10mL盐酸反应,计算生成的H2在标准状况下的体积[V(H2)]。缺少的数据是,计算式为
右图为实验室某浓盐酸试剂瓶标签上的有关数据,根据有关数据回答下列问题:
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g/m3 质量分数:36.5% |
(1)该浓盐酸中HCl的物质的量浓度为mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量不随所取体积多少而变化的是。
A、溶液中HCl的质量 B、溶液的p H
C、溶液中H+的数目 D、溶液的密度
(3)欲配制上述浓盐酸,需要在1L水中通入标态下L
HCl气体(保留1位小数)
(4)现有1L1mol/L的稀盐酸,欲使其浓度增大1倍,采取的措施合理的是。
A、通入标况下HCl气体22.4L B、将溶液加热浓缩至0.5L
C、加入5mol/L的盐酸0.6L,再稀释至2L。 D、加入1L 3mol/L的盐酸混合均匀。
使用启普发生器制取气体,具有随时可控制反应进行和停止的优点。某化学兴趣小组制作了如图所示的装置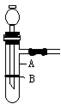 ,代替启普发生器。
,代替启普发生器。
(1)图中A仪器的名称是,缺少的仪器是,
(2)制作B使用的是()
A、铁片 B、铝箔 C、纸片 D、塑料片
(3)在该装置中用下列反应制气体,反应原理可行,且可能达到上述优点的是()
A、Na2CO3·10H2O+HCl→CO2↑ B、Cu+H2SO4→H2↑ C、CaCO3+HNO3→CO2↑
(4)若用该装置进行锌粒与稀硫酸反应制取氢气的实验;对装置作气密性检查的方法是,
(5)向装置中加入锌粒的方法是。
(6)当需反应停止时的操作和发生的现象是。
用18mol/L浓硫酸配制480ml 1.0mol/L稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③稀释④转移、洗涤⑤定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是。
A、10ml B、25ml C、50ml D、100ml
(2)实验需要的仪器除容量瓶、烧杯、量筒外,还需要。
(3)第③步实验的操作是
。
(4)下列情况对所配制的稀硫酸浓度有何影响(用偏大、偏小、无影响填写)
A、所用的浓硫酸长时间放置在密封不好的容器中。
B、容量瓶用蒸馏水洗涤后残留有少量的水。
C、未冷却至室温即转移并定容
D、定容时俯视溶液的凹液面
(1)、将CO、O22种气体分别盛放在2个容器中,并保持2个容器内气体的温度和密度均相等,这2种气体对容器壁所施压强的大小关系是。
(2)、同温、同压下某瓶充满O2时重116克,充满CO2重122克,充满某气体时重114克。则某气体的相对分子质量为。
(3)、A物质按下式分解:2A=B↑+2C↑+2D↑,测得生成的混合气体在相同条件下的密度是H2密度的m倍,则A的摩尔质量为。