(1)1mol/L的①盐酸、②醋酸、③硫酸各1L,分别加入足量的铁。开始反应时产生氢气的速率__________,最终收集到的氢气的物质的量_______;若氢离子浓度相同的①盐酸、②醋酸、③硫酸各1L,分别加入足量的铁,开始反应时产生氢气的速率________,最终收集到的氢气的物质的量____________(填序号)。
(2)如果在稀氨水中进行下列操作,则下列指定微粒浓度如何变化?试用“增大”“减小”“不变”填写。
①通适量HCl气体时,c(NH3) ,c(H+) 。
②加入少量NaOH固体时,c(NH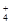 ) ,c(OH-) 。
) ,c(OH-) 。
(3)某温度下纯水中c(H+) = 2×10-7 mol/L,则c(OH-) = ,若温度不变,滴入稀盐酸使c(H+) = 5×10-6 mol/L,则此时溶液中的c(OH-) = 。
(4)用物质的量浓度为0.04mol/L的氢氧化钠溶液去中和H+浓度为10-3mol/L的某一元弱酸溶液20mL,消耗氢氧化钠溶液12.5mL,则此一元弱酸物质的量浓度为 ;电离度为 。
mg 铁粉与一定量的HNO3在一定条件下充分反应,将生成的气体与标准状况nL氧气混合,恰好能被水完全吸收,m和n的关系是什么?
Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝 酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经
酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经 氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
钢铁工业对促进经济和社会发展起了重要作用。



 (1)炼铁高炉分为五部分,铁矿石与高温煤气主要在部分发生反应,在部分开始生成铁和炉渣。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在部分发生反应,在部分开始生成铁和炉渣。 (2)炼钢时,除磷的化学方程式为;
(2)炼钢时,除磷的化学方程式为; 加入硅、锰和铝的目的是。
加入硅、锰和铝的目的是。 (3)不锈钢含有的Cr元素是在炼钢过程的氧吹(填"前"或"后")加入,原因是。
(3)不锈钢含有的Cr元素是在炼钢过程的氧吹(填"前"或"后")加入,原因是。 (4)炼铁和炼钢生产中,尾气均含有的主要污染物是。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是。 从环保和经济角度考虑,上述尾气经处理可用作。
从环保和经济角度考虑,上述尾气经处理可用作。
由
、
、
、
、
中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去):

 (1)取少量溶液
,加入过量的
溶液,有沉淀生成。取上层清液,通入
,无明显变化,说明样品中不含有的物质是(填化学式)。
(1)取少量溶液
,加入过量的
溶液,有沉淀生成。取上层清液,通入
,无明显变化,说明样品中不含有的物质是(填化学式)。 (2)
为一种或两种气体:
(2)
为一种或两种气体: ①若
只为一种气体,试剂
为饱和
溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是。
①若
只为一种气体,试剂
为饱和
溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是。 ②若
为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是。
②若
为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是。 (3)向
中通入过量的
,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)。
(3)向
中通入过量的
,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)。 (4)取
中的溶液,调节
约为7,加入淀粉
和
,溶液呈蓝色并有红褐色沉淀生成。当消耗2
时,共转移3
电子,该反应的离子方程式是。
(4)取
中的溶液,调节
约为7,加入淀粉
和
,溶液呈蓝色并有红褐色沉淀生成。当消耗2
时,共转移3
电子,该反应的离子方程式是。 (5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生
中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示)。
(5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生
中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示)。
利用下图所示的装置,可以验证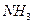 和HCl的有关性质。实验前a、b、c活塞均关闭。
和HCl的有关性质。实验前a、b、c活塞均关闭。
(1)通过挤压胶头滴管和控制活塞的开关,若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是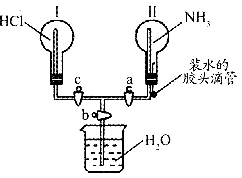
(2)通过挤压胶头滴管和控制活塞的开关,在烧瓶l中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是