下图是元素周期表中1-3周期的原子结构简图,据图回答相关问题。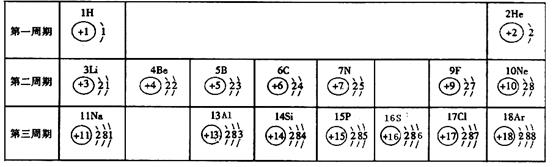
(1)请画出8号元素原子结构示意图 ;该元素在化学反应中容易 (填“得到”或“失去”)电子,12号元素、8号元素和1号元素一起形成的化合物的化学式为 ;
(2)已知,Al(OH)3 既可以与盐酸等强酸反应,也可以与强碱NaOH反应生成偏铝酸钠(NaAlO2)和水,写出Al(OH)3与NaOH反应的化学方程式 ;
(3)归纳第2周期元素原子结构中核外电子排列的规律: (任写一条)。
燃料的燃烧在人类社会的发展过程中起着相当重要的作用。
(1)煤、和天然气并称为三大化石燃料;煤燃烧会释放出二氧化硫、二氧化氮等污染物,这些气体或气体在空气中反应后的生成物溶于雨水,形成酸雨,酸雨的
(填"
"、"
"或"
")
;向盛有少量酸雨的锥形瓶里滴入几滴石蕊溶液,溶液变成色。
(2)化石燃料是不可再生能源,燃烧时对环境造成不良影响。现代人们正在利用和开发新能源,请任意列举一种新能源:。
右图是
、
两种固体物质的溶解度曲线,请回答下列问题:
(1)30℃时,
物质的溶解度(填">"、"="或"<")
物质的溶解度。
(2)曲线上
点表示。
(3)写出一种使接近饱和的
溶液转化为饱和溶液的方法。
防止金属的腐蚀是保护金属资源的一条有效途径。
(1)铁在空气中的锈蚀,实际上是铁跟空气中的和水蒸气共同作用的结果。
(2)为了防止铁锈蚀,人们常采用在其表面涂油、刷漆或镀铬等方法。这些方法的共同防锈原理是。
(3)稀盐酸常用来清除铁锈,请写出用稀盐酸清除铁锈的化学方程式。
结合厨房中的常用物质,回答下列问题:
(1)我们的主食是大米和面食,它们所含的主要成分属于六大营养素中的;
(2)制作高压锅的手柄的塑料属于(填"热塑性"或"热固性") 塑料。
请选择下列物质的正确序号填入适当空格中:
①熟石灰 ②金刚石 ③碳酸氢钠 ④食醋
(1)农业上常用于改良酸性土壤的是;
(2)硬度大,可用于刻划玻璃的是;
(3)可用于除去热水瓶胆内壁水垢[主要含
和
]的是;
(4)在焙制糕点中,作为发酵粉的主要成分之一的是。