含有1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是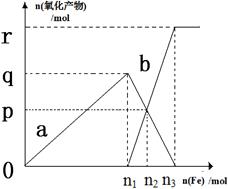
| A.a是Fe(NO3)2 | B.n1 = 0.375 | C.p = 0.20 | D.n2 = 0.30 |
已知丁基有四种同分异构体,戊基有八种同分异构体。某组成为C5H12O的醇可被氧化成为C5H10O的醛,具有这种结构的醇的同分异构体共有( )
| A.2种 | B.4种 | C.8种 | D.14种 |
膜材料ETFE为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯。下列说法错误的是( )
| A.ETFE分子中可能存在“—CH2—CH2—CF2—CF2—”的连接方式 |
| B.合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 |
C.聚全氟乙丙烯分子的结构简式可能为 |
| D.聚全氟乙丙烯不能使酸性高锰酸钾溶液褪色 |
下列说法正确的是( )
| A.除去混在甲烷中的乙烯,可将混合气体通过盛有酸性高锰酸钾溶液的洗气瓶 |
| B.乙醇与钠反应比钠与水反应要缓慢得多,反应时都是钠浮在液面上、熔成光亮小球 |
| C.可用灼烧闻气味的方法快速鉴别蚕丝和人造丝 |
| D.乙烯来自石油,所以来自石油分馏的汽油能使酸性高锰酸钾溶液褪色,植物油则不能使酸性高锰酸钾溶液褪色 |
下列各组中的反应,属于同一反应类型的是( )
| A.乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷 |
| B.乙醇和乙酸制乙酸乙酯;苯的硝化反应 |
| C.葡萄糖与新制氢氧化铜共热;蔗糖与稀硫酸共热 |
| D.乙醇和氧气制乙醛;苯和氢气制环己烷 |
如下实验操作正确且能达到实验目的的是( )
| A.用铁粉与稀硝酸反应,制取少量氢气,用排水法收集 |
| B.在蒸发皿中给十水碳酸钠加热脱水 |
| C.用酸式滴定管量取6.55 mL的KMnO4溶液 |
| D.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |