食品安全关系国计民生,影响食品安全的因素很多.
(1)聚偏二氯乙烯(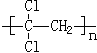 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由_______(写结构简式)发生加聚反应生成的.
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由_______(写结构简式)发生加聚反应生成的.
(2)劣质植物油中的亚油酸[CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH]含量很低.下列关于亚油酸的说法中,正确的是_________ .
A.分子式为C18H34O2
B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应
D.能使酸性KMnO4溶液退色
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:____ __ .
(4)劣质奶粉中蛋白质含量很低.蛋白质水解的最终产物是______ ___ .
(5)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖.请设计实验证明淀粉已经完全水解,写出操作、现象和结论:______ ___ .
(6)下列有关实验的叙述,正确的是_____(填序号)
A、用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液
B、分馏石油时,温度计的末端必须插入液面下
C、用分液漏斗分离环己烷和水的混合液体
D、用浓氨水洗涤做过银镜反应的试管
E、配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
F、蔗糖水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖
(10分)工业合成氨的反应: 是一个放热反应。已知该反应生成2molNH3时,放出92kJ的热量.
是一个放热反应。已知该反应生成2molNH3时,放出92kJ的热量.
⑴相同条件下,1 mol N2和3 mol H2所具有的能量(“大于”、“小于”、“等于”)2 molNH3具有的能量;
⑵如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量(“大于”、“小于”、“等于”)上述数值,其原因是;
⑶实验室模拟工业合成氨时,在容器为2L的密闭容器内,反应经过10min后,生成10 mol NH3,则用N2表示的该反应速率为:;
⑷一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是
a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值 d.N2和H2的浓度相等
e. N2、H2和NH3的体积分数相等 f.反应达到最大限度
甲同学设计了如下图所示的原电池,电解质溶液为FeCl2溶液,但灯泡不亮。 乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题:
乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题: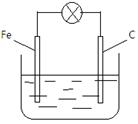
⑴乙同学换了一个电极 ,如果他的铁片更换,你认为可以换成(化学式)
,如果他的铁片更换,你认为可以换成(化学式)
⑵丙同学把电解质溶液换成了FeCl3溶液,写出电极方程式,
负极:正极:
(5分)有下列几种物质:①Ne ②NH4Cl ③NaOH ④Cl2 ⑤KNO3⑥CO2 ⑦H202 ⑧Na2O2
属于共价化合物得是(填序号,下同),只存在极性键的是,既存在极性键又存在非极性键的是,既存在极性键又存在离子键的是,既存在离子键又存在非极性键的是。
常温下,有pH值为12的NaOH溶液100 ml,欲将其pH值变为11,采取下列三种措施(忽略混合过程中溶液体积的变化),请回答有关问题:
(1)若加水,应加入ml。
(2)若用pH=10的NaOH溶液,应加入ml。
(3)若用pH=2的盐酸,应加入ml。
(6分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学 化学知识回答下列问题:
化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序___。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)浓度为0.1mol/L的(NH4)2Fe(SO4)2溶液与(1)相比c(NH4+)中的大(填化学式)