(1)23.75g某二价金属的氯化物(MCl2)中含有3.01×1023Cl-,则MCl2的摩尔质量是________,MCl2的相对分子质量是________,M的相对原子质量是________。
(2)2 mol 尿素[CO(NH2)2]所含氧原子跟________ g H2O所含氧原子个数相等。
(3)标准状况下,22.4 L CH4;②1.5 mol NH3;③1.806×1024个H2O;④标准状况下,73 g HCl。所含H原子个数由多到少的顺序是________。
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行分析:
(1)该同学准备了下列实验用品:20% NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请你帮他设计一个实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
(2)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U形管中,请根据此装置在下列两项中择一
回答:
①若不是原电池,请说明原因: (如果回答此题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是: 。
(3)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理:。
化合物C是一种合成药品的中间体,其合成路线为:

已知: 
(1)写出 中官能团的名称。
中官能团的名称。
(2)写出反应①的化学方程式。
(3)反应②属于反应(填有机反应类型)。
(4)D是比 多一个碳的同系物,则满足下列条件的D的同分异构体共有种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式。
多一个碳的同系物,则满足下列条件的D的同分异构体共有种,写出一种满足条件且含4种不同氢原子的同分异构体的结构简式。
①显弱碱性,易被氧化;②分子内含有苯环;③能发生水解反应
(5)请你设计由A合成B的合成路线。提示:①合成过程中无机试剂任选;②合成路线表示方法示例如下: 。
。
开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是:。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是,曲线Ⅱ对应的实验条件改变是。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]
①下列说法中正确的是。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ) =10ˉ1 mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是(填晶体类型)。
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
| X |
Y |
Z |
|
| W |
(1)X元素在元素周期表中的位置_____________。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为_______________。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器____(填“能”或“不能”)用来腌制咸菜,原因是_________________________________________。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________。
关于该电池的下列说法,正确的是______
A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平: 。
。
下图是两座工厂的主要生产流程以及它们之间的生产关系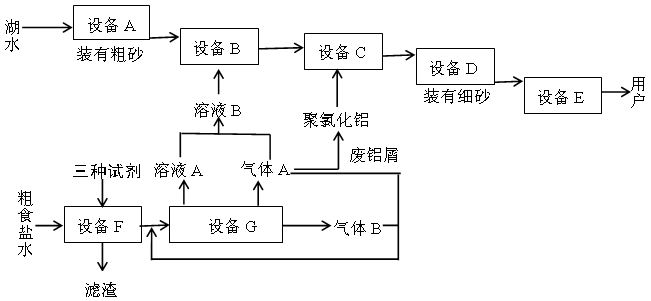
回答下列问题:
(1)与上图中“设备A”的作用相当的实验装置是。
(2)“溶液B”也可以用下列物质中的什么物质代替?。
a.KAl(SO4)2·12H2O b.ClO2 c.大量O3 d.K2Cr2O7e.活性炭
(3)聚氯化铝在生产过程中作剂,其作用是,可用离子方程式表示其化学原理如下(用Al3+代表聚氯化铝):。
(4)上图中下方的工厂主要生产两种气体和一种常见强碱,通常称为工业。
(5)加入“三种试剂”主要是为了除去粗食盐水中的Ca2+、Mg2+、SO42-等杂质,按加入的先后次序写出化学式。
(6)制取“溶液B”的方法现在已作了改进,其原理图,用离子方程式表示该装置中发生的反应:。