软锰矿的主要成分为MnO2,工业可用其按如下方法制备高锰酸钾:
a.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30 min,冷却得墨绿色熔渣(主要成分为K2MnO4);
b.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
c.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是: ,用化学方程式表示出MnO2转化为K2MnO4的反应原理: 。
(2)粉碎后的软锰矿与苛性钾置于 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式: 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是: 。
(5)若将母液循环使用,可能造成的问题是: 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是: 。
有下列化学仪器:①托盘天平,②玻璃棒,③药匙,④烧杯,⑤量筒,⑥容量瓶,⑦胶头滴管,⑧细口试剂瓶,⑨标签纸。
(1)现要配制500 mL、1 mol·L-1的硫酸溶液,需用质量分数为98%、密度为1. 84 g·cm-3的浓硫酸__________________mL。
(2)从上述仪器及标签纸中,按实验使用的先后顺序,其编号排列是___________
(3)容量瓶在使用前需要检验_____________。
(4)下列操作对硫酸的物质的量浓度有何影响(填“偏高”、“偏低”、“不变”)。
摇匀后发现液面低于刻度线再加水:_________容量瓶中原有少量蒸馏水:_______。
定容时俯视观察液面:___________
现有三组溶液:①汽油和水溶液②39%的酒精溶液⑧氯化钠和硝酸钾的水溶液,分离以上各混合液的正确方法依次是_________、___________、______________(填“过滤”、“萃取”、“分液”、“蒸馏”、“结晶”等)。
现有一定量含有Na2O杂质的Na2O2试样,用图K2-6-2所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水) 回答下列问题:
回答下列问题:
(1)装置A中液体试剂选用____________,理由是________________________________。
(2)装置B的作用是___________________________________________,装置E中碱石灰的作用是______________________________________________________________________。
(3)装置D中发生反应的化学方程式是_________________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_________________。
已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉—碘化钾溶液。请完成以下实验探究过程:
【提出假设】
假设1:溶液呈黄色不是发生化学反应所致,是溶液中引起的(填微粒的化学式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中引起的。
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案:。
假设2方案:。
(2)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为。
附加题:(实验班同学必做)
下图是两个实验装置(铁架台等辅助仪器略去未画)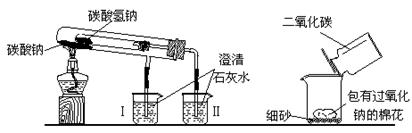

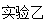
回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是(填“Ⅰ”、“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是:,通过实验甲可比较出Na2CO3、NaHCO3两种固体,更稳定。
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花着火燃烧。写出Na2O2与CO2反应的化学方程式,棉花能着火燃烧说明该反应特点是。
(3)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g。则原混合物中碳酸钠的质量分为