下图曲线a和b是盐酸与氢氧化钠溶液的相互滴定的滴定曲线,下列叙述正确的是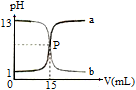
| A.NaOH溶液的浓度为0.1 mol·L-1 |
| B.P点时恰好完全反应,溶液呈中性 |
| C.曲线a是盐酸滴定氢氧化钠溶液的测定曲线 |
| D.本实验的指示剂不能用甲基橙,只能用酚酞 |
零排放燃料电池曾被美国《时代》杂志列为21世纪改变人类生活的十大新科技之首。其中最具代表意义的质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极。下列说法中不正确的是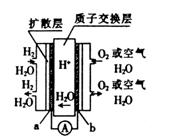
| A.a极为该电池的负极 |
| B.该电池的正极反应式为O2 + 4H+ + 4e- =2H2O |
| C.该电池的能量转化主要形式是化学能转化为电能 |
| D.H+(质子)由正极移动至负极 |
某温度下,体积和pH均相同的氢氧化钠溶液和氨水分别加水稀释,溶液的pH随溶液体积(V)变化的曲线如图所示,则下列判断中正确的是
| A.I是氨水的pH变化曲线 |
| B.b、c两点溶质的浓度相等 |
| C.中和a点时氨水和氢氧化钠溶液所需硫酸的物质的量相等 |
| D.c→d的变化过程中,溶液中所有离子的浓度均减小 |
一定条件下,向2L恒容密闭容器中加入2molX、1 molY,发生如下反应:2X(g) + Y  3Z(g);△H =" -a" kJ/mol (a>0)。经过60 s达平衡,此时Y的物质的量为0.2mol。
3Z(g);△H =" -a" kJ/mol (a>0)。经过60 s达平衡,此时Y的物质的量为0.2mol。
下列说法中错误的是
| A.用Z表示的化学反应速率为1.2 mol·L—1·min—1 |
| B.若再充入1 mol Z,重新达平衡时,X的体积分数不变,则Y为气态 |
| C.达平衡后,实际放出的热量为b kJ,则b=a |
| D.若使容器体积变为1L,Z的物质的量不会增大 |
下列各组离子在碱性条件下能大量共存,且在强酸性条件下能发生氧化还原反应的是
A.Ca2+、Al3+、SO 、Cl— 、Cl— |
B.K+、Na+、SO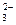 、NO 、NO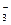 |
C.Na+、K+、NO 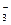 、SO 、SO |
D.NH 、Na+、Cl—、CO 、Na+、Cl—、CO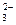 |
下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤C、Si
A. 只有①③ B. 只有②④ C. ①②③④ D. ①②③④⑤