常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)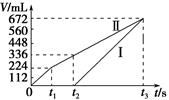
(1)原混合溶液中NaCl和CuSO4的物质的量浓度。
(2)电解至t3时,消耗水的质量。
将某温度下的KNO3溶液200 g蒸发掉10 g水,恢复到原温度,或向其中加入10 g KNO3固体,均可使溶液达到饱和。试计算:
(1)该温度下KNO3的溶解度。
(2)原未饱和溶液中溶质的质量分数。
在标准状况下,SO2和O2混合气体500 mL,通过灼热V2O5层后,体积变为450 mL(恢复到原状况),将此450 mL气体通过足量NaOH溶液后,溶液增重0.985 g,求原混合气体中SO2的质量。
在150 mL 0.2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水的电解),则:
(1)若两极均为铜片,试说明电解过程中Cu2+浓度将怎样变化。_____________________。
(2)若阳极为纯锌,阴极为铜片,阳极的电极反应式是______________________________。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重________g,阴极上的电极反应式是___________________________。