把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题: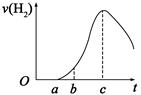
(1)曲线由O →a段不产生氢气的原因(请用有关反应的化学方程式表示)是 。
(2)曲线a→c段,产生氢气的速率增加较快,而曲线由c以后,产生氢气的速率逐渐下降,解释上述现象的原因是 。
(3)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为 (假设反应前后溶液体积不变)。
(4)对于足量镁条和100ml 2mol/L硫酸生成氢气的反应,下列措施能减缓反应速率,但又不影响生成氢气的总量的是 。
① 加NaOH固体;
② 加适量BaCl2溶液;
③ 加KNO3溶液;
④ 加适量H2O;
⑤ 将镁条换成镁粉;
⑥ 加小苏打溶液;
⑦ 加少量CuSO4溶液;
⑧ 加适量Na2SO4溶液;
⑨ 将2 mol/L硫酸换成160mL 2.5mol/L的盐酸 ;
(5)若使用催化剂,会不会使氢气的产量增加? (填“会”或“不会”)。
目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2+3H2  CH3OH+H2O,该反应的能量变化如图所示:
CH3OH+H2O,该反应的能量变化如图所示:
(1)甲同学认为该反应为放热反应,他的理由为: 。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)= ;反应达到平衡状态,此时H2的转化率为 。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.H2的消耗速率与CH3OH的消耗速率之比为3∶1
(1)已知甲烷燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-=CO32-+7H2O这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(2)已知吸热反应2HI(g) ===H2(g) + I2(g)吸收热量11kJ,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(1)为了达到下表中的实验要求,请从“供选择的化学试剂及方法”栏中,选择正确选项的字母代号填入对应的空格中。
| 序号 |
实验要求 |
答案 |
供选择的化学试剂及方法 |
| a |
检验乙酸是否具有酸性 |
A.新制的氢氧化铜悬浊液 |
|
| b |
检验植物油中是否含有碳碳双键 |
B.紫色石蕊试液 |
|
| c |
检验尿液中是否含有葡萄糖 |
C.加入饱和Na2CO3溶液,分液 |
|
| d |
除去乙酸乙酯中的少量乙酸 |
D.溴水 |
(2)A的结构简式如下:A分子中两种含氧官能团的名称是 、 。
请写出该物质与足量的金属钠发生反应的化学方程式 。
目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2+3H2  CH3OH+H2O,该反应的能量变化如图所示:
CH3OH+H2O,该反应的能量变化如图所示:
(1)甲同学认为该反应为放热反应,他的理由为: 。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)= ;反应达到平衡状态,此时H2的转化率为 。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.H2的消耗速率与CH3OH的消耗速率之比为3∶1
(1)已知甲烷燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-=CO32-+7H2O这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(2)已知吸热反应2HI(g) ===H2(g) + I2(g)吸收热量11kJ,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。