为确定某酸HA是弱电解质,两同学的实验方案如下:
甲:①称取一定质量的HA,配制0.1 mol·L-1的溶液100 mL;
②用pH计测出该溶液的pH,根据pH="-lg" c(H+),推算出溶液中H+的浓度,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制0.1mol·L-1的两种酸溶液各100 mL;
②分别取配制的这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是___ ___。
(2)甲方案中说明HA是弱电解质的理由是测得溶液的H+的浓度_ _0.1 mol·L-1(选填“>”、“<”或“=”)。
(3)乙方案中说明HA是弱电解质的现象是_ __。
A.装盐酸的试管中放出气体的速率快;
B.装HA溶液的试管中放出气体的速率快;
C.两个试管中产生气体的速率一样快。
(4)请你评价:乙方案中的不妥之处:______ ___________________________。
(5)已知在T°C时,0.1 mol·L-1HA溶液中HA的电离度为5%,求该温度下HA的电离常数(写出计算过程)
(8分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验完成下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为___________。
(2)在粗盐经过溶解、过滤后的溶液中滴加稍过量BaCl2溶液,目的是除去___________。
(3)再滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是_________________________。最后加适量盐酸将多余的Na2CO3除去。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中
都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:玻璃棒用来搅拌,加速溶解。
过滤时:______________________________________________________________________。
蒸发时:______________________________________________________________________。
试样X由FeO和CuO组成。取质量相等的两份试样按如下所示流程图进行实验: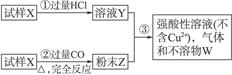
(1)请写出步骤③中所发生的全部反应的离子方程式。
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,每份试样X中氧化铜的质量为__________(用m表示)。
硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,硫酸亚铁药片外表包有一层特制的糖衣,以保护硫酸亚铁不被空气中的O2氧化成硫酸铁。请设计一种方法,验证某硫酸亚铁药品是否已被氧化。请写出主要步骤、现象及化学方程式。
实验室中用右图装置制取氯气: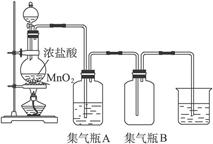
试完成下列问题:
(1)该反应是氧化还原反应吗?___________,如果是氧化还原反应,请指出___________是氧化剂,___________是还原剂,写出该反应的离子方程式______________________________。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是______________________________________________。
(3)氯气溶于水显酸性,且氯气有毒,并有强烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用____________________溶液来吸收有毒的氯气。
实验室制取SO2的反应原理为:Na2SO3+H2SO4(较浓)====Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率。
(1)这些装置的连接顺序(按气体左右的方向)是_________→_________→_________→
_________→_________→_________→_________→(填各接口的编号)。
(2)实验时甲仪器的作用与原理是
_________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是____________。
(4)Ⅳ处观察到的现象是_____________________________________________。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为___________。