有四种短周期元素,它们的结构、性质等信息如下表所述:
| 元素 |
结构、性质等信息 |
| X |
构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y |
短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z |
与Y同周期,其最高价氧化物的水化物呈两性 |
| M |
海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)X元素在周期表中的位置是______________,其相对分子质量最小的气态氢化物的化学式是______________。
(2)Y离子半径比Z离子的半径______(填“大”或“小”),Y元素的最高价氧化物的水化物和Z元素的最高价氧化物相互反应的离子方程式是:_____________________。
(3)X与M两元素的气态氢化物的稳定性更强的是______________(填化学式),请再举出一个实例比较M与X两元素的非金属性强弱(用化学方程式表示)______________。
高纯二氧化硅可用来制造光纤。某稻壳灰的成分为:
| 组分 |
SiO2 |
C |
Na2O |
K2O |
Al2O3 |
Fe2O3 |
| 质量分数 |
59.20 |
38.80 |
0.25 |
0.50 |
0.64 |
0.61 |
通过如下流程可由稻壳灰制备较纯净的二氧化硅。
请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有类。
(2)步骤①中涉及SiO2的离子反应方程式为 。
(3)滤渣A的成分有(填化学式)
(4)步骤③反应的化学方程式为:;
(5)实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、和。
某溶液可能含有K+、Mg2+、Al3+、Cl2、SO42-、S2-、NO3-中的几种,为确定溶液中的微粒种类,进行如下实验:
①通过观察,发现溶液呈浅黄绿色;
②取少许原溶液,滴加NaOH溶液直至过量,发现先有沉淀生成,后沉淀减少但并不完全消失;
③取少许原溶液,滴加BaCl2溶液,无白色沉淀生成。
请根据上述信息回答下列问题:
(1)原溶液中肯定存在上述微粒中的________________,肯定不存在的微粒有_______________。
(2)不能确定是否存在上述微粒中的______________________,确定其是否存在的实验方法是____________________(不要求写具体操作过程)。
(3)若步骤②中得到沉淀的最大质量为9.7g,最终剩余沉淀质量为5.8g,据此步骤可确定原溶液中一定存在的微粒的物质的量之比为____________________。
(4)下列离子还可以在原溶液中大量共存的是___________(填字母)。
| A.OH- | B.Fe2+ | C.NH4+ | D.CO32- |
金属镁是六方最密堆积,金属铜是面心立方最密堆积,下图分别给出它们的堆积状况和晶胞示意图,它们空间利用率相同,假定镁、铜原子均为刚性小球,已知球的半径分别为R1厘米、R2厘米,阿伏伽德罗常数NA
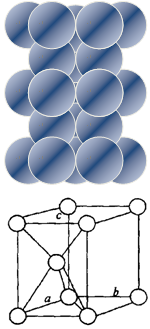 |
(1)镁原子在二维空间的配位数为 |
| (2)位于晶胞中部的鎂原子与离它最近两平面 (填“相离”或“相切”或”相交”) |
|
| (3)请用含R1、NA的数学式子表达金属镁的密度: g/cm3(根号带在分子上) |
|
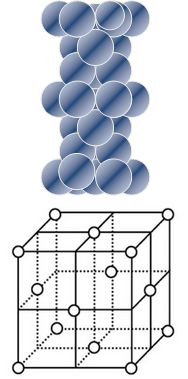 |
(4)铜原子在三维空间的配位数为 |
| (5)晶胞中面心上的六个铜原子构成的空间几何体名称为 |
|
| (6)请用含R2、NA的数学式子表达金属铜的密度: g/cm3(根号带在分子上) |
工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)反应物A的化学式为,属于晶体。
(2)生成物中由分子组成的物质属于极性分子的是(写分子式),由分子组成的晶体中熔点较高的是(写分子式),由分子组成的晶体中密度较大的是(写分子式)
(3)反应物中有两种元素在元素周期表中位置相邻,请用一个化学方程式来表示它们的非金属性的大小,并请写出其中电负性较小的元素原子的价层电子排 布图:。
(4)制取冰晶石(Na3AlF6)的化学方程式中除氢外,其余原子的第一电离能由大到小的顺序
(5)冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如图所示,●位于大立方体顶点和面心 ,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是(填具体的微粒符号)。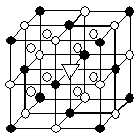
红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
请回答下列问题。
(1)气态 PCl5生成气态PCl3和Cl2的热化学方程式为。
(2)PC15生成 PCl3和Cl2是一个可逆反应,向5.0L密闭容器中充入0.1 md PCl5(g),反应在不同条件下进行,反应体系总压强随时间的变化关系如图所示。
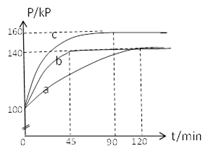
①实验b中PCl5的平衡分解率为,其他条件不变,在该实验中再加入 0.1 mol PCl5 (g) ,平衡分解率(填“增大”、“减小”或“不变”)。
②与实验a相比,c改变的条件是,判断依据是。
(3)PCl5露置于潮湿空气中,能水解生成两种中学化学常见酸,其化学方程式为。
(4)人的牙齿表面有一层釉质,其组成为羟基磷灰石 Ca5( PO4)3OH(Ksp=6.8×10-37)。为了防止蛀牙,人们常使用含氟离子的牙膏,其中的氟化物可使轻基磷灰石转化为氟磷灰石Ca5( PO4)3F(Ksp=1.0×10-60)。写出该反应的离子方程式,该反应的平衡常数为。