某班学生分成甲,乙两小组分别探究硫,氮及其化合物的性质:
(一)甲组同学用下列装置来探究浓硫酸与木炭粉加热反应并验证反应所产生的各种产物。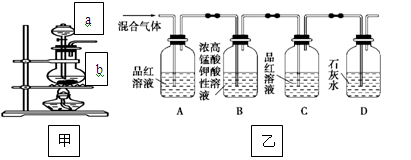
(1)装置甲中盛放浓硫酸的仪器a名称是_______________,
装置甲中仪器b中发生反应的化学方程式为______________________________________
(2)实验中可观察到装置乙中,A瓶的溶液褪色,C瓶的溶液不褪色。
A瓶溶液的作用是__________________________________________________,
B瓶溶液的作用是__________________________________________________,
D瓶溶液的现象是__________________________________________________。
(二)乙组同学用下列装置来证明铜与稀硝酸反应产生一氧化氮,
B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为________________________________________________________________。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是________________________。
(5)装置D的作用是_____________________________________________________。
(8分)现有 A、B、C、D、E五瓶无色溶液分别是HC1、BaCl2、NaHSO4、K2CO3、AgNO3溶液中的一种,已知:
①A与B反应有气体产生
②B与C反应有沉淀生成
③C与D反应有沉淀生成
④D与E反应有沉淀生成
⑤A与E反应有气体产生
⑥在②、③反应中生成的沉淀为同一种物质.
请填写下列空白: (1)A是,B是,D是。
(2)写出⑤反应的离子方程式.
(3)将 0.1 mol/L 的 Ba(OH)2溶液与 0.1 mol/L 的E溶液按下表中的不同配比进行混合:
| 甲 |
乙 |
丙 |
丁 |
戊 |
|
| 0.1 mol/L 的Ba(OH)2溶液的体积/mL |
10 |
10 |
10 |
10 |
10 |
| 0.1 mol/L 的E溶液的体积/mL |
5 |
10 |
15 |
20 |
25 |
①按丁方式混合后,所得溶液显 (填"酸""碱""中" )性.
②按乙方式混合时,反应的离子方程式为.
(12分)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应氧化产物与还原产物质量比是
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,这时候,观察到的现象是___________________________;
(3)某学生在一次分液操作中发现上下层溶液都是无色液体,无法知道分液漏斗中的液体哪一层是有机层,哪一层是水层,请你用简单的方法帮他鉴别出来,写出有关步骤及判断____________________________ 。
(4)在容量瓶的使用方法中,下列操作正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(5)上面实验中用到一定物质的量浓度的稀硫酸,若配制0.5mol/L的硫酸溶液450mL,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______ mL,如果实验室有15mL、20mL、50mL量筒,应选用________ mL量筒最好。
(6)下面操作造成所配稀硫酸溶液浓度偏高的是_____________
A.溶解的时候溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
 (1)已知KBrO3在反应中得到电子,则该反应的还原剂是。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是。 (2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为。 (3)根据上述反应可推知。
(3)根据上述反应可推知。 a.氧化性:KBrO3>H3AsO4b.氧化性:H3AsO4> KBrO3
a.氧化性:KBrO3>H3AsO4b.氧化性:H3AsO4> KBrO3 c.还原性:AsH3>X d.还原性:X > AsH3
c.还原性:AsH3>X d.还原性:X > AsH3 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥标出电子转移的方 向和数目:
向和数目:

处于下列状态的物质中:①硫酸钡晶体②干冰③液态HCl④铜
⑤蔗糖⑥熔融的硝酸钾⑦NaCl溶液
(1)能导电的是(填字母,下同);
(2)属于电解质的是;
(3)属于非电解质的是。
工业制氢气的一个重要反应是:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知在25℃时:
①C(石墨)+1/2O2(g)=CO(g) △H1=-111kJ·mol-1
②C(石墨)+O2(g)=CO2(g) △H2=-394kJ·mol-1
③H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ·mol-1
则反应CO(g)+H2O(g) =CO2(g)+H2(g)的反应热△H=___________。
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡状态所需时间/min |
||
| CO |
H2O |
H2 |
CO2 |
|||
| I |
650 |
4 |
2 |
1.6 |
1.6 |
5 |
| II |
900 |
2 |
1 |
0.5 |
0.5 |
3 |
| III |
900 |
a |
b |
c |
d |
t |
①对于反应CO(g)+H2O(g) CO2(g)+H2(g),下列说法正确的是_________
CO2(g)+H2(g),下列说法正确的是_________
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率 (CO)=_____;
(CO)=_____;
③实验II条件下反应的平衡常数K=_____________(保留小数点后二位);若某温度T时,该反应的平衡常数为0.5,则T_____900℃(填“>”或“<”)
④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______;
⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时v(正)_____v(逆)(填“>”或“<”),平衡向______方向移动(填“正反应”、“逆反应”或“不移动”)
⑥若仅改变温度,纵坐标y随T变化如图所示,
则纵坐标y表示的是
A.CO2的百分含量 B.混合气体的平均相对分子质量
C.CO的转化率 D.H2O的物质的量