做完氢氧化钠与稀硫酸中和反应的实验后,兴趣小组的同学对反应后溶液中的溶质成分产生了兴趣,请你与他们一起进行以下探究。
【提出问题】溶液中的溶质是什么物质?
【作出猜想】(1)甲同学认为溶液中的溶质只有
一种物质。
(2)乙同学认为溶液中的溶质是
和
(3)丙同学认为溶液中的溶质是
和NaOH两种物质。
【查阅资料】①
溶液显中性。
②
与强碱
溶液反应生成偏铝酸钠(
)等物质。
【实验验证】
| 实验操作 |
实验现象 |
实验结论 |
|
| 乙同学 实验 |
取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液中 |
铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色 |
猜想(2)成立 |
| 丙同学 实验 |
取中和反应后的溶液少许于试管中,向试管中滴加几滴无色酚酞试液 |
溶液变 |
猜想(3)成立 |
【总结反思】丁同学根据乙、丙两位同学的实验现象,首先肯定猜想(1)不成立。经过进一步分析,丁同学认为猜想(2)也不成立,他的理由是
【知识拓展】(1)生活中能否用铝制品来盛放强碱性溶液?
(2)乙同学的实验中铝片与
不正确的实验操作,可能会对实验产生影响或造成严重的后果.
(1)下列仪器可以直接加热的是:(选填序号):
①烧杯②锥形瓶③集气瓶④蒸发皿
(2)下列图示实验操作中,正确的是:(选填序号).
请你参与某学习小组研究性学习的过程,并协助完成相关任务。
【研究课题】探究水壶内部水垢的主要成分
【查阅资料】通过查阅资料知道,天然水和水垢所含的物质及其溶解性如下表:
| 物质 |
Ca(HCO3)2 |
Mg(HCO3)2 |
Ca(OH)2 |
Mg(OH)2 |
CaCO3 |
MgCO3 |
| 溶解性 |
可溶 |
可溶 |
微溶 |
不溶 |
不溶 |
微溶 |
【提出猜想】水垢的主要成分一定含有Mg(OH)2和,可能含有Ca(OH)2和。
【设计方案】
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,静置。取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无(填化学式)。
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分。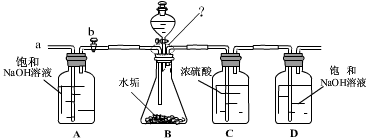
其主要实验步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,逐滴加入足量稀盐酸。若D瓶增重22g,则水垢全部是CaCO3。
②待锥形瓶中不再产生气泡时,打开活塞b,从导管a处缓缓鼓入一定量的空气;
③称量D瓶内物质增加的质量;
④重复②和③的操作,直至D瓶内物质质量不变。
测量滴加稀盐酸体积与D瓶内物质增加质量的关系如图曲线所示;
【评价】
①A瓶中的NaOH溶液起到作用。若A瓶中无NaOH溶液,D瓶中的质量将(填“增大”、“不变”或“减小”)。
②一般情况下,两种不同金属形成的碳酸盐与足量盐酸反应时,若两金属的化合价相同、两种盐的质量相同,则相对分子质量小者放出的气体多。分析曲线图可知:水垢中一定含有(化学式),理由是。
③装置图中“?”所指处有三根导管同时穿过橡胶塞,已知:导管的直径为8mm,橡胶塞细段直径为3cm。从坚固和美观的角度考虑,请你在由图中标出应在哪三点打孔为好(用圆圈“○”表示打孔位置)。
以上实验(填“能够”或“不能”)检测出水垢中含有Mg(OH)2。
碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成。
(1)提出问题:黑色固体是什么?
(2)猜想与假设: 黑色固体可能是:①;②可能是炭粉;③可能是炭粉和氧化铜的混合物。请你补充猜想①。作出这些猜想的依据是。
(3)实验方案: 他们称取了2.22g碱式碳酸铜在试管中高温加热使之完全分解,冷却至室温,称得黑色固体产物的质量为1.6g。
(4)实验反思:① 甲同学经过思考后,认为可以排除猜想③,理由是(用化学方程式表示)。
② 乙同学根据质量守恒定律:化学反应前后,元素的种类和质量都不变。通过对得到的数据进行计算,排除了猜想②,他的理由是(通过计算式说明)。
(5)实验结论:结合甲、乙同学的探究和查阅资料,丙同学确认只有猜想①成立。
(6)实验拓展:丙同学想进一步探究该黑色固体的化学性质。他发现实验室有一瓶无色溶液,其标签严重破损(如图),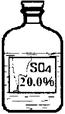
老师告诉他该瓶试剂是硫酸、硫酸钠或硫酸镁溶液中的一种。他通过查阅资料得知常温下这三种物质的溶解度如下表:
| 物 质 |
H2SO4 |
Na2SO4 |
MgSO4 |
| 常温下的溶解度∕g |
与水以任意比互溶 |
18.0 |
39.0 |
丙同学根据以上信息,分析此溶液一定不是溶液。为确定其成分,他取了少量黑色固体放入试管中,然后向其中滴加了一定量的该无色溶液后,发现黑色固体全部消失,溶液由无色变为蓝色。他确定该溶液为。其反应的化学方程式为。
(共12分)为确定木炭还原氧化铜后的固体成份,请你与兴趣小组的同学完成以下探究。
【对固体猜想】
猜想I:全部是金属铜;猜想Ⅱ:除铜外,还含有氧化铜;
猜想Ⅲ:除铜外,还含有木炭;猜想Ⅳ:除铜外,还含有氧化铜、。
【进行实验】实验流程见下图: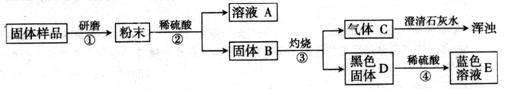
【问题与讨论】
(1)步骤②包括溶解、两步操作,它们共同用到的玻璃仪器是烧杯、。
(2)C的化学式为,D的化学式为,由此推出固体B中含有
(写化学式),步骤④发生反应的化学方程式为。
(3)结合(2)的结论推断:如果溶液A显蓝色,则溶液A的溶质的化学式为,说明样品中含有,则证明猜想成立;如果溶液A无色,则证明猜想成立。
一瓶无色液体A,含有NaCl、NaOH和Na2CO3中的两种;一包白色粉末B,含有CaO、Ca(OH)2和CaCO3中的两种。化学小组的同学为了探究A和B的成分,设计了如下图所示的实验方案,请根据图示过程回答问题。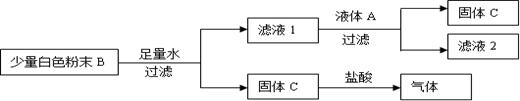
(1)固体C难溶于水,是一种常见的补钙产品,则固体C是,与盐酸反应的化学方程式为。
(2)液体A中一定含有的一种溶质为,白色粉末B中一定含有的一种物质为。试写出滤液1与液体A之间发生反应的化学方程式为。
(3)小组同学们分析发现:假设溶液A滴加适量,若滤液2中只含有一种溶质,则原无色溶液A中含有的另外一种溶质是;若滤液2中含有两种溶质,则原无色溶液A中含有的另外一种溶质是。