高分子材料PET聚酯树脂和PMMA的合成路线如下: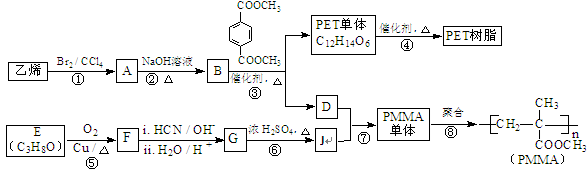
已知:
Ⅰ.RCOOR’+ R’’18OH RCO18OR’’+R’OH(R、R’、R’’代表烃基)
RCO18OR’’+R’OH(R、R’、R’’代表烃基)
Ⅱ. 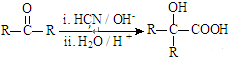 (R、R’代表烃基)
(R、R’代表烃基)
(1)①的反应类型是 。
(2)②的化学方程式为 。
(3)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为 。
(4)G的结构简式为 。
(5)下列说法正确的是 (填字母序号)。
a.1 mol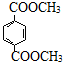 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
b.B和D互为同系物
c.⑦为酯化反应
d.D的沸点比同碳原子数的烷烃高
(6)与J具有相同官能团的J的同分异构体有多种,请写出其中无甲基的一种 。
用离子方程式表示下列反应
(1)Cl2通入NaHCO3水溶液中
(2)向Fe(NO3)2滴入几滴稀硫酸
(3)SO2通入高锰酸钾酸性溶液中
(4)向FeBr2通入等物质的量的Cl2
(5)向明矾溶液中滴入Ba(OH)2溶液,使得产生的沉淀质量最大
(10分)把等物质的量的Cu、Fe粉投入一定量的FeCl3溶液中充分反应后取出部分溶液,
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有_________。
(2)若加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有_________,可能存在的金属粉末有_________。
(3)若加入的金属全部溶解,则溶液中n(Cu2+):n(Fe2+)是_________。
(4)若(3)反应后的溶液中有3种金属离子,欲从中回收Cu和FeCl3,需要用到的试剂有(按反应顺序填写)___________________________。
(5)在500mL 0.1 mol·L-1的FeCl2溶液中通入一定量Cl2,待反应结束后,将溶液稀释到1 L,再取出1/10稀溶液加入足量的AgNO3溶液,得到2.009g沉淀。原溶液中被氧化的Fe2+的物质的量为__________mol;若将剩余的Fe2+全部氧化,还需加入0.5 mol·L-1的稀硝酸_________ mL。
已知X、Y、Z三种元素都属于1~18号元素,它们的核电荷数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的3倍,Y和Z形成的单质都是自然界循环的两种气体,且Y和Z可以形成两种以上的气态化合物,则;
(1)X、Y、Z的元素名称分别为_______ , ________ , ________
(2)有Y和Z组成,且Y和Z的质量比为7:16的化合物的化学式为________ 或_________
(3)有X、Y、Z中的两种元素组成,且与X2Z分子具有的电子数的两种离子是______和_____
(4)X、Y、Z三种元素可以形成一种盐,此盐中X、Y、Z元素原子的个数比为4︰2︰3,该的化学式是_______
(10)下图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1。B为常见液体。
试回答下列问题:
(1)X是__________________; F是___________________。
(2)A D反应的化学方程式并标出电子转移的方向和数目_______________________________。
D反应的化学方程式并标出电子转移的方向和数目_______________________________。
(3)G与Cu的反应中,G表现_______________________性质。
(4)X与过量NaOH溶液反应的离子方程式:。
(5)以C、B、D为原料可生产G,若使a mol C 完全转化为G,理论上至少需要D ____________mol 。
某种芳香烃0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过过量的浓硫酸和碱石灰,结果是浓硫酸增重9g,碱石灰增重35.2g。
(1)求该有机物的分子式?
(2)实践中可根据核磁共振氢谱(PMR)上观察到氢原子给出的峰值情况,确定有机物的结构。此含有苯环的有机物,在PMR谱上峰给出的稳定强度仅有四种,它们分别为:① 3∶1∶1②1∶1∶2 ∶6③3∶2④3∶2∶2∶2∶1 ,请分别推断出其对应的结构:
①;②;
③;④。