已知水在25℃和95℃时,其电离平衡曲线如下图所示:
(1)25℃时水的电离平衡曲线应为 (选填“A”或“B”)
(2)25℃时,将PH=9的NaOH溶液与PH=4的盐酸溶液混合,若所得混合溶液的PH=7,则NaOH溶液与盐酸溶液的体积比为 。
(3)95℃时,若100体积PH=a的某强酸溶液与1体积ph=b的某强碱溶液混合后溶液呈中 性,则混合前,a与b之间应满足的关系是

(1)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl+S" +SO2。请回答下列问题:
①电池的负极材料为,发生反应(填“氧化”或“还原”)。
② SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为;
(2)过度排放CO 会造成“温室效应”,科学家正在研究如何将CO
会造成“温室效应”,科学家正在研究如何将CO 转化为可以利用的资源,其中一种方案就是将CO
转化为可以利用的资源,其中一种方案就是将CO 转化为可再生燃料甲醇(CH
转化为可再生燃料甲醇(CH OH)。其化学方程式为:CO2(g) +3H2(g)
OH)。其化学方程式为:CO2(g) +3H2(g) 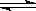 CH3OH(g) + H2 O(g),请填空:
CH3OH(g) + H2 O(g),请填空:
①写出上述反应的平衡常数表达式K:_________________
②选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极应加入或通入的物质是
③25℃,1.01×10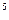 Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________.
Pa时16 g液态甲醇完全燃烧,当恢复至原状态时,放出362.9 kJ热量,此反应的热化学方程式为______________________________.
(16分)(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)="" CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)= 2H2O(1)△H<0
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为。通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的状态,则电解过程中转移的电子的物质的量为
②若电解含有1molNaCl溶液400ml,当阳极产生的气体448mL(标准状况下)时,溶液的C(OH—) = (假设电解后溶液体积不变)。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”、“向右”或“不”);使用催化剂反应的△H(填“增大”、“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”、“向右”或“不”);使用催化剂反应的△H(填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e-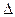 H1=" +" 1175.7 kJ·mol-1
H1=" +" 1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g)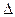 H2=" -" 771.1 kJ·mol-1
H2=" -" 771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g)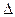 H3=" +" 482.2 kJ·mol-1
H3=" +" 482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的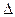 H="_____________" 。
H="_____________" 。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为
。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显性(填“酸”、“碱”或“中”) 高
高
(1)下列有关实验操作或结果的说法中错误的是
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),和两种粒子的物质的量之和比OH―多0.05mol。
(8)向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加的NaOH溶液的体积(mL)关系如下图所示,试回答下列问题: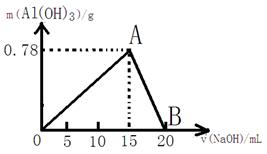
(1)上述两步反应用总的离子方程式可表示为:;
(2)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为。
(写出计算过程)