有X、Y、Z、M 、N按原子序数依次递增的五种短周期元素,其中Z、M、N同周期,X、Z同主族且X是原子半径最小的原子;Y、N同主族,Z+与Y2—具有相同的电子层结构;M的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)M的元素名称 ,N在元素周期表中的位置 。
(2)离子半径比较:r(Z+) r(Y2—)。
(3)X与Z形成的化合物A是 (填“离子化合物”或“共价化合物”),A与X2Y反应的化学方程式是 。
如图为相互串联的甲乙两个电解池,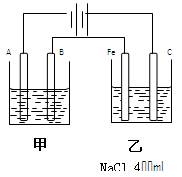
请回答:
(1)甲池若为电解精炼铜的装置,A极是,材料是,电极反应为,B极是,材料是,电极反应为。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为。
(3)若乙槽剩余液体为400mL,求电解后得到碱液的物质的量浓度。
在一定体积的密闭容器中,进行如下化学反应:
C(s)+H2O(g)  CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t/(℃) |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.7 |
0.8 |
1.0 |
1.6 |
2.4 |
(1)该反应的化学平衡常数表达式为K=________,该反应为________反应(填“吸热”或“放热”)。
(2)能作为判断反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.c(H20)不变
C.v正(H2)=v逆(H2O) D.c(H2)=c(CO)
(3)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积,平衡________移动(填“正向”、“逆向”或“不”)。H2O(g)的浓度_______,CO(g)的浓度_______(填“变大”、“不变”或“变小”)
Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) ,△H=?,反应情况记录如下表:
pC(g) ,△H=?,反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)=mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min或;
②第6min;③第8 min。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H=。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K=。
(5) 判断第9 min时是否达平衡,说明理由。
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为。
A.大于7 B.等于7 C.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为mol•L-1,B溶液中水电离出的氢离子浓度为mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为:。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如下图所示(部分产物已略去)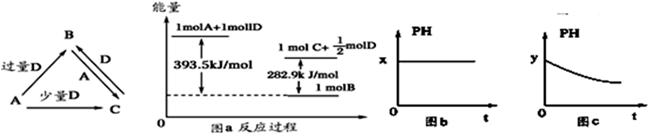 (1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 ________________ 。
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 ________________ 。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则 ①C的化学式为 _______________。
②反应B+A→C的离子方程式为 ____________。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的蒸发)
①若图b符合事实,则D为(填化学式),此时图b中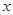 7(填“﹥”“﹤”“=”)。②若图c符合事实,则其pH变化的原因是(用离子方程式表示)
7(填“﹥”“﹤”“=”)。②若图c符合事实,则其pH变化的原因是(用离子方程式表示)
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出1molA和D反应生成C的反应热为ΔH=。
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。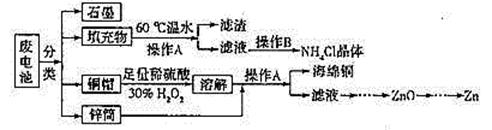
(1)填充物用60℃温水溶解,目的是。
(2)操作A的名称为。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式:。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示: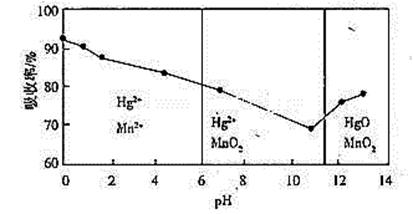
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率___.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下强.