甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。

①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
| 实验编号 |
T(°C) |
n(CO)/n(H2) |
p(MPa) |
| ⅰ |
150 |
½ |
0.1 |
| ⅱ |
________ |
________ |
5 |
| ⅲ |
350 |
________ |
5 |
[化学—有机化学基础]选做碳、氢、氧 3 种元素组成的有机物A,相对分子质量为 102,含氢的质量分数为9.8%,分子中氢原子个数为氧的 5 倍。
(1)A的分子式是 。
(2)A有 2个不同的含氧官能团,其名称是、。
(3)一定条件下,A 与氢气反应生成 B,B 分子的结构可视为 1 个碳原子上连接 2 个甲基和另外2 个结构相同的基团。则A 可以发生的反应是(填写序号字母)。
a.加聚反应b.消去反应c.酯化反应d.还原反应
(4)写出一个与A 具有相同官能团,不带有支链的同分异构体的结构简式:。
(5)A 的一种酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是 。
(6)已知环氧氯丙烷可与乙二醇发生如下聚合反应:
B 也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是________________。
[化学—物质结构与性质]选做人类生活和工业生产都离不开金属。请根据相关信息回答:
(1)235U可用于核能发电。科学家们采用“气体扩散法”从UF6 获得高浓度的235U。已知UF6在常温常压下是固体,在56.4℃升华成气体,说明UF6属于 晶体。
(2)某丁香酸金属铜配合物的结构简式如下图所示,请回答。
该化合物中碳原子的杂化方式有 ,Cu原子的外围电子排布式 。
(3)某铜的配合物在煤的液化中起催化作用,其阳离子结构如下图。
①在该离子内部含有的化学键类型有(填字母)。
a.离子键
b.极性键
c.非极性键
d.配位键
e.范德华力
f.氢键
②煤液化获得的甲醇经催化氧化可得到重要工业原料甲醛(HCHO)。甲醇的沸点 64.96℃,甲醛的沸点-21℃,甲醛的沸点更低的原因是分子间没有氢键。你认为甲醛分子间没有氢键的原因是。
③甲醛分子σ键和π键的个数比为。
(4)具有6 配位的Co3+的配合物[Co(NH3)mCln]Cl(3-n)具有一定的抗肿瘤活性。1 mol该配合物与足量AgNO3溶液反应生成2 mol AgCl沉淀,则m= 、n=。
铁的化合物在生产生活中的应用广泛。
(1)高铁酸钾(K2FeO4)具有强氧化性,是一种新型高效水处理剂,它在水处理过程中(铁元素被还原为+3 价)的两个作用是____________、_____________。
(2)氧化铁是重要工业颜料,用废铁屑制备它的流程如下图。请回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是____________、______________;
②操作I所得滤液中若加入碱性较强的(NH4)2CO3溶液,还会产生 Fe(OH)2,可能的原因是: ,该反应的平衡常数K=(填数值)。【已知:Ksp(FeCO3) = 3.2×10-11,Ksp(Fe(OH)2) = 8.0×10-16】
,该反应的平衡常数K=(填数值)。【已知:Ksp(FeCO3) = 3.2×10-11,Ksp(Fe(OH)2) = 8.0×10-16】
③写出在空气中煅烧FeCO3获得氧化铁产品的化学方程式_____________________;
④煅烧如果不充分,产品中将有Fe2+存在,检验产品中有无Fe2+的实验操作是_______。
(3)含 Cr2O72-的酸性废水可加入FeSO4 将其转化为无毒的Cr3+,反应的离子方程式为 。
物质的类别和核心元素的化合价是研究物质性质的两个重要视角。硫及其化合物与价态变化为坐标的二维转化关系如图所示。完成下列填空:
(1)图中X的水溶液在空气中放置易变浑浊,写出反应的化学方程式:;
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度
分析,理论上有可能实现的方案是 (选填编号)。
a.Na2S + S b.Z + S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)请补充完整焙烧明矾的化学方程式:
___KAl(SO4)2·12H2O +____S = ____K2SO4 + ____Al2O3 + ____SO2↑ +
(4)研究反应Na2S2O3 + H2SO4 ="=" Na2SO4 + S↓ + SO2↑+ H2O的速率时,下列方案合理的是(选填编号)。
a.测定一段时间内生成SO2的体积,得出该反应的速率
b.研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c.用Na2S2O3(s)分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(5)治理含CO、SO2的烟道气,以铝钒土做催化剂,将CO、SO2在380℃时转化为S 和一种无毒气体。已知:①硫的熔点:112.8℃、沸点:444.6℃;
②反应每得到1mol硫,放出270kJ的热量。写出该治理烟道气反应的热化学方程式。
(6)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图。不考虑催化剂价格因素,生产中选铝矾土做催化剂的主要原因是。
(原创)化学反应原理在生产和科研中有着重要的应用,请利用相关知识回答下列问题。
(1)一定条件下在密闭容器中加入NH4I发生反应:
a.NH4I(s)  NH3(g)+HI(g)
NH3(g)+HI(g)
b.2HI(g)  H2(g)+I2(g)
H2(g)+I2(g)
则反应a的平衡常数表达式为_______;达到平衡后,扩大容器体积,反应b的移动方向_______(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2 N2O4△H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
N2O4△H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
| A.b点的操作是压缩注射器 |
| B.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc |
D.d点: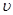 (正)> (正)> 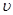 (逆) (逆) |
(3)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
①电极a为______极,其电极反应式为________________
②当有2.24 L NO2(标准状况下)被处理时,转移电子为____________mol
③为使电池持续放电,该离子交换膜需选用_______(选填“阳”或“阴”)离子交换膜。
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式______________________________。
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,为抑制肼的分解,可采取的合理措施有_________________________________ (任写一种)。