[化学—物质结构与性质]选做人类生活和工业生产都离不开金属。请根据相关信息回答:
(1)235U可用于核能发电。科学家们采用“气体扩散法”从UF6 获得高浓度的235U。已知UF6在常温常压下是固体,在56.4℃升华成气体,说明UF6属于 晶体。
(2)某丁香酸金属铜配合物的结构简式如下图所示,请回答。
该化合物中碳原子的杂化方式有 ,Cu原子的外围电子排布式 。
(3)某铜的配合物在煤的液化中起催化作用,其阳离子结构如下图。
①在该离子内部含有的化学键类型有 (填字母)。
a.离子键
b.极性键
c.非极性键
d.配位键
e.范德华力
f.氢键
②煤液化获得的甲醇经催化氧化可得到重要工业原料甲醛(HCHO)。甲醇的沸点 64.96℃,甲醛的沸点-21℃,甲醛的沸点更低的原因是分子间没有氢键。你认为甲醛分子间没有氢键的原因是 。
③甲醛分子σ键和π键的个数比为 。
(4)具有6 配位的Co3+的配合物[Co(NH3)mCln]Cl(3-n)具有一定的抗肿瘤活性。1 mol该配合物与足量AgNO3溶液反应生成2 mol AgCl沉淀,则m= 、n= 。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度的升高,混合气体的颜色变深。
2NO2(g),随温度的升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H0(填“>”或“<”);
100℃时,体系中各物质浓度随时间变化如图所示。
在0~60s时段,反应速率v(N2O4)为mol•L-1•s-1;反应的平衡常数K1=mol/L。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡。则:
① T100℃(填“>”或“<”)。
② 计算温度T时反应的平衡常数K2=mol/L。
(3) 温度T时反应达平衡后,将反应容器的容积减少一半,则平衡向(填“正”或“逆”)反应方向移动。
在2L密闭容器中,充入a molN2和b molH2,在一定温度下N2+3H2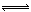 2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是,H2的转化率是,容器中H2的平衡浓度是mol/L,该温度下平衡常数的数值为。(用a、b、c表示出计算式即可)
2NH3,达到平衡,容器中还剩余c molN2,则平衡时N2的转化率是,H2的转化率是,容器中H2的平衡浓度是mol/L,该温度下平衡常数的数值为。(用a、b、c表示出计算式即可)
(10分) 用“>”、“=”、“<”填写。
(1)常温下,将0.1mol/L的醋酸溶液和0.1mol/L醋酸钠溶液等体积混合,测得溶液显酸性,则该混合液中: c(CH3COOH)c(CH3COO-);2c(Na+)c(CH3COO-)+c(CH3COOH);
(2)常温下,将0.1mol/L的HCN溶液和0.1mol/L的NaCN溶液等体积混合,测得混合液中c(HCN)>c(CN-),(假设混合过程中溶液体积的改变忽略不计)。则该混合液pH7,c(HCN)+c(CN-)0.1mol/L, c(HCN)-c(CN-)2c(OH-)。
请写出下列溶液水解(或双水解)的离子反应方程式:
(1)次氯酸钠溶液:
(2)硫酸铵溶液:
(3)明矾净水原理:
(4)泡沫灭火器工作原理:
(5) 氯化铁溶液与偏铝酸钾溶液混合:
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为。
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是%(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是
。
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是(填字母序号)。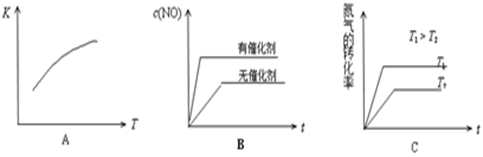
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数(填“变大、“变小”或“不变”)。