下列是构成原电池的实验方案, 请按要求回答下列问题:
(1)电解质溶液为0.5mol·L-1硫酸溶液,电极为用砂纸打磨过的镁片和铝片,设计成原电池,则铝片为
极(填“正”或“负”),正极电极反应式为 ;若将电解质溶液改为0.5mol·L-1氢氧化钠溶液,则被氧化的是 (填“镁片”或“铝片”),该原电池总反应的离子方程式为:
(2)以“Fe+2Fe3+===3Fe2+ ”反应为原理设计原电池,请在以下该原电池装置图括号中写出电极材料及电解质溶液。
已知在催化剂作用下,苯和卤代烃反应可以在苯环上引入烷烃基,生成苯的同系物。如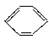 +CH3CH2Cl
+CH3CH2Cl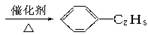 C2H5+HCl,现从苯出发制取十二烷基苯,再进一步制取合成洗涤剂十二烷基苯磺酸钠,分子式为
C2H5+HCl,现从苯出发制取十二烷基苯,再进一步制取合成洗涤剂十二烷基苯磺酸钠,分子式为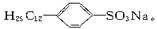
提供的原料除苯外,还有水、浓硫酸、十二烷、食盐及催化剂等,试用化学方程式表示此制取过程。(已知电解食盐水生成Cl2、H2和NaOH)
(1)______________________________(2)_______________________________;
(3)______________________________(4)______________________________;
(5)______________________________。
下列两幅谱图是结构简式为CH3CH2CH2OH和CH3CH(OH)CH3的两种有机化合物的1H核磁共振谱图。请判断哪一幅是CH3CH(OH)CH3的1H-NMR谱图,并说明理由。
有人曾提出苯除了有平面正六边形结构外,还可能有空间立体结构,例如下面的Ⅰ式和Ⅱ式:
Ⅰ式: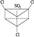
Ⅱ式: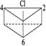
(1)若以Ⅰ式为主体,其一元取代物分子中2,4,6位上的氢原子性质相同,3,5位上的氢原子性质相同。则2,4,6-三氯硝基苯的结构简式为__________。
(2)若Ⅱ式分子生成二氯苯,其可能有的同分异构体有___________种。