已知A是一种重要的化工原料,A的产量可以用来衡量一个国家石油化工发展水平的标志,E是具有果香气味的烃的衍生物。A、B、C、D、E在一定条件下存在如下转换关系(部分反应条件、产物被省略)。
(1)工业上,由石油获得重油的方法是_________;图中素瓷片的作用是 。
(2)写出B和D反应生成E的化学方程式 。
请指出表中分子的空间构型,判断其中哪些属于极性分子,哪些属于非极性分子,并与同学讨论你的判断方法。
| 分子 |
空间构型 |
分子有无极性 |
分子 |
空间构型 |
分子有无极性 |
| O2 |
HF |
||||
| CO2 |
H2O |
||||
| BF3 |
NH3 |
||||
| CCl4 |
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
⑴写出实验流程中下列物质的化学式
试剂X :沉淀A:沉淀B:
⑵上述实验流程中加入过量的Na2CO3的目的是。
⑶按此实验方案得到的溶液3中肯定含有(填化学式)杂质。
(Ⅰ)A、B、C三种无色可溶性盐分别是由Na+、Ag+ 、Ba2+、Cl—、NO3— 、CO32—中不同的阴、阳离子所组成。经实验A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为、B为。将B和C的溶液混合反应的离子方程式为:。
(Ⅱ)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验: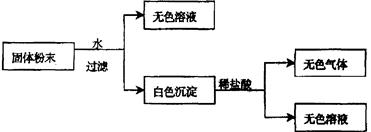
从实验可以判断,该固体粉末中一定不含有,它的组成可能是
或。
A、B、C、D、E 5瓶透明溶液,分别是HCl 、BaCl2、NaHSO4、Na2CO3、AgNO3溶液中的一种。
①A 与B反应有气体生成② B与C反应有沉淀生成③C与D反应有沉淀生成④D与E反应有沉淀生成⑤A与E反应有气体生成⑥在②和③的反应中生成的沉淀是同一种物质B是__________D是___________ (均填化学式)
下列物质:①铜丝②碳酸③氯化氢气体④稀硝酸⑤二氧化硫气体⑥氨水⑦蔗糖晶体⑧熔融氯化钠⑨氧化钠固体⑩硫酸铜晶体(用相应序号填空)
⑴上述物质可导电的是_________________⑵属于电解质的是__________________
(3)属于强电解质的是