(1)已知肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa、25℃时,0.5 mol液态肼与足量氧气反应,生成氮气和水蒸气,放出312 kJ的热量,写出该反应的热化学方程式
(2)已知每千克氢气在常温常压下燃烧约放出热量1.43×105 kJ,每千克汽油燃烧约放出热量4.6×104 kJ,氢气被公认为是21世纪替代矿物燃料的理想能源,氢气作为能源的优点有: 。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: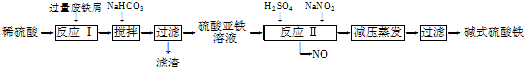
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为,此时的温度为(从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置: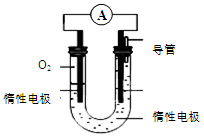
①该电池的能量转化形式为。
②该电池正极的电极反应为。
③工作一段时间后,测得溶液的pH减小,则该电池总反应的化学方程式为 。
化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过下图所示方法合成: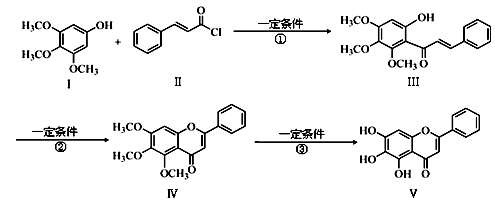
回答下列问题:
(1)化合物Ⅲ的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2。
(2)化合物Ⅱ的合成方法为:
合成肉桂酸的反应式中,反应物的物质的量之比为1︰1。反应物A的结构简式是 。
(3)反应①的反应类型为 。化合物Ⅰ和Ⅱ反应还可以得到一种酯,生成该酯的反应方程式为。(不用注明反应条件)
(4)下列关于化合物Ⅳ、Ⅴ的说法正确的是(填序号)。
a.都属于芳香化合物
b.都能与H2发生加成反应,Ⅳ消耗的H2更多
c.都能使酸性KMnO4溶液褪色
d.都能与FeCl3溶液发生显色反应
(5)满足以下条件的化合物Ⅰ的同分异构体Ⅵ的结构简式为
①遇FeCl3溶液显示特征颜色
②l mol Ⅵ与浓溴水反应,最多消耗1 mol Br2
③Ⅵ的核磁共振氢谱有五组峰,峰面积之比为1︰1︰2︰2︰6
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④........
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)装置A中反应的化学方程式为。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端要使沉积的FeCl3进入收集器,第④步操作是。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)。
(4)装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;②。
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下: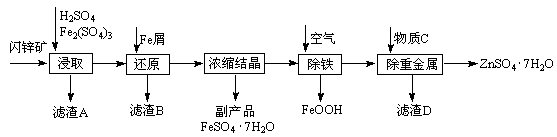
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为。
(2)浸取过程中Fe2(SO4)3的作用是,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是。
(4)置换法除重金属离子所用物质C为。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| 溶解度/g |
41.8 |
54.1 |
70.4 |
74.8 |
67.2 |
60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为、、过滤、干燥。