为研究亚氯酸钠(NaClO2)吸收SO2的利用率,某课外小组设计如下图所示实验(加热和夹持装置略去)。
(1)甲装置中发生反应的化学方程式为 。
(2)当观察到丙装置中 时(填现象),停止实验。
(3)探究亚氯酸钠与SO2的反应。
①假设SO2被完全反应,检验乙装置中生成的SO42-和C1-,应选用的试剂是 (酸性条件下ClO2-不干扰检验)。
a.稀硝酸
b.稀盐酸
c.BaCl2溶液
d.Ba(NO3)2溶液
e.AgNO3溶液
②完成乙装置中反应的离子方程式:
(4)测定亚氯酸钠的利用率。实验步骤如下:
ⅰ 将乙装置中溶液取出,加入过量KI晶体,再滴入适量稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。
ⅱ 将步骤ⅰ所得溶液稀释至100. 00mL,取25.00 mL于锥形瓶中,滴入1~2滴淀粉溶液,用0.500 mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-)。重复进行3次滴定,得Na2S2O3溶液体积的平均值为20.00 mL。
①步骤ⅱ中将溶液稀释至100.00mL,需要用到的玻璃仪器有烧杯、玻璃棒、 、 。
②该实验NaClO2的利用率为 。
(5)实验结束后,课外小组同学经讨论认为:增大SO2的溶解量,有利于提高NaClO2的利用率。增大SO2的溶解量的措施有 (填一种)。
(12分)某化学探究学习小组同学在实验室中配制100mL 3.6 mol·L-1的稀硫酸。
(1)若采用18 mol·L-1的浓硫酸配制溶液,需要浓硫酸的体积为。
(2)下列实验步骤是配制溶液所必需的步骤,请使用各步骤的编号按照实验操作时的顺序进行排序(只填各步骤的编号)。
①溶解并恢复至室温;②定容;③计算;④转移;⑤量取;⑥洗涤并转移;⑦反复倒转摇匀。
(3)实验中除了需要50mL量筒、烧杯、玻璃棒外,还需要的仪器有
。
(4)定容的正确操作是
。
(5)该小组在实验室中发现了一张注射用质量分数为5%的葡萄糖(分子式为C6Hl2O6,相对分子质量为180)溶液的标签,如下图所示。
则该溶液中含水g;该溶液的物质的量浓度为(小数点后保留2位数)。
呋喃甲醇和呋喃甲酸是有机合成中的常用试剂,可用呋喃甲醛制备,其实验原理为: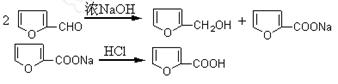
制备方法如下:①在50mL烧杯中放置3.28mL(0.04mol)呋喃甲醛,并用冰水冷却;称取1.6gNaOH溶于少量水中,在搅拌下滴加氢氧化钠水溶液于呋喃甲醛中。②在8~12℃下连续搅拌40min。③向反应混合物加入适量水使其恰好完全溶解,用乙醚萃取分液。④乙醚萃取物用无水硫酸镁干燥后,先在水浴中蒸去乙醚,然后蒸馏,收集169~172℃馏分得1.4g产品。⑤在乙醚提取后的水溶液中慢慢滴加浓盐酸到pH=3,搅拌,冷却,结晶,抽滤。⑥产物用少量冷水洗涤,抽干后,收集粗产物。再提纯后得精产品1.5g。
(1)本实验中,氢氧化钠必须溶于少量的水,否则水量过大主要会影响__________收率。
(2)本实验中要充分连续搅拌40min,其目的是______________________________。
(3)萃取时,用到的主要硅酸盐质的仪器是__________;抽滤的优点是______________________________________________________________________。
(4)呋喃甲酸粗产品提纯的方法是________________________________________。
(5)本实验中呋喃甲酸的产率为________________________________________ 。
盛极一时一种实验室常用的化学试剂,请按要求填空: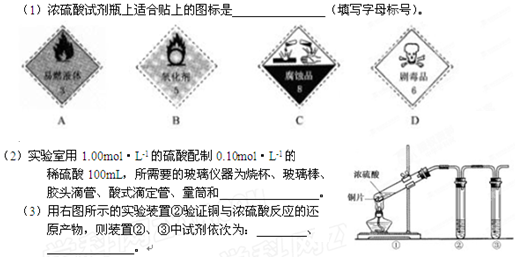
(4)装置①的反应方程式
若装置①中加入铜6.4克和含有0.2摩尔硫酸的浓硫酸产生二氧化硫
A等于6.4克 B 大于6.4克 C 小于6.4克 D不能确定
化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学用向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到的实现现象是___________,②反应过程中发生反应的化学方程式是。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物称为铁酸盐(含有FeO42-)。
Ⅱ.SCN-的电子式为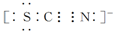
III.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl2可将Fe3+氧化为FeO42-,请写出该离子反应方程式__________。
②第二种假设是:____________,提出该假设的理论依据是___________________
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如 下:
下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):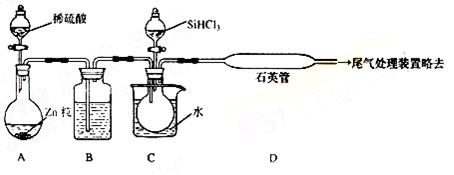
①装置B中的试剂是 ,装置C中 的烧瓶需要加热,其目的是: 。
的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生 反应的化学方程式为 。
反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量 铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水b.氯水 c.NaOH溶液d.KSCN溶液e.Na2SO3溶液