水是重要的自然资源。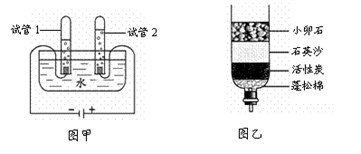
(1)图甲是电解水的实验装置示意图。通电一段时间后,试管1产生的气体名称为 ,该实验说明水是由 组成的。
(2)图乙是家用简易净水装置,该净水装置中小卵石、石英沙的主要作用是 ,经过此净水器得到的水仍然不是纯水,若想得到纯水可采用的方法是 。
(3)若用过滤的方法在实验室净化一杯浑浊的水,必须使用的玻璃仪器:烧杯、玻璃棒和 ,其中玻璃棒的作用是 。
(4)某学校饮水处可以将自来水净化为饮用水,其中处理步骤如下图所示:
①对应的作用是 (填字母序号,下同),
a.杀菌消毒 b.吸附杂质 c.沉淀过滤 d.蒸馏
(5)保护水资源是每个公民应尽的责任和义务。下列防止水污染的措施可行的是 。
| A.抑制水中所有动植物生长 | B.不任意排放工业废水 |
| C.禁止使用农药和化肥 | D.生活污水处理后再排放 |
用化学符号或文字表示:
(1)钠元素 (2)三个磷原子
(3)两个氧分子 (4)2H
A元素的原子结构示意图为:
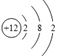 则A元素在化学反应中容易 电子(填得到或失去)变成_________离子(填阴或阳),属于_________元素(填金属或非金属);B元素的离子结构示意图为: ,该离子带__________个单位正电荷,该元素的原子核外总共有_________个电子。
则A元素在化学反应中容易 电子(填得到或失去)变成_________离子(填阴或阳),属于_________元素(填金属或非金属);B元素的离子结构示意图为: ,该离子带__________个单位正电荷,该元素的原子核外总共有_________个电子。
我国目前列入空气污染指数的项目暂为: 、 、 、可吸入颗粒物和臭氧等。
实验室里的药品,有的有毒性,有的有腐蚀性,所以,使用药品时,不能 ,不要 ,特别注意不得 。