下列叙述正确的是
| A.甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 |
B.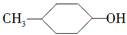 的消去产物有两种 的消去产物有两种 |
| C.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2==CH—COOCH3 |
| D.可用溴水鉴别乙醛、四氯化碳、苯和乙酸 |
下列有关说法正确的是
A.反应NH3(g) + HCl(g) NH4Cl(s)在室温下可自发进行,则该反应的△H<0 NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B.0.01 mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质 |
| C.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
| D.在化学平衡、电离平衡、水解平衡中,平衡常数都随温度的升高而增大 |
表示下列用途或变化的离子方程式不正确的是
| A.泡沫灭火器灭火原理:Al3++3HCO3-= 3CO2↑+ Al(OH)3↓ |
B.纯碱代替洗涤剂洗涤餐具:CO32- + H2O HCO3-+ OH- HCO3-+ OH- |
C.明矾净水原理:Al3++3H2O  Al(OH)3+3H+ Al(OH)3+3H+ |
D.NaHCO3的水解:HCO3-+H2O H3O++CO32- H3O++CO32- |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是
| A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.用MgCl2·6H2O制取无水MgCl2时需在HCl气流中进行 |
对羟基扁桃酸是合成香料的重要中间体,它可由如下反应制得: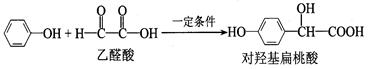
下列说法中,不正确的是
| A.上述反应的原子利用率是100% |
| B.对羟基扁桃酸的核磁共振氢谱有6个吸收峰 |
| C.对羟基扁桃酸可以发生加成反应、取代反应、消去反应和缩聚反应 |
| D.1 mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH |
下列实验操作正确且能达到预期目的的是
| 选项 |
实验目的 |
操作 |
| A |
比较水和乙醇中羟基氢的活泼性强弱 |
用金属钠分别与水和乙醇反应 |
| B |
证明CH2=CHCHO中含有碳碳双键 |
滴入KMnO4酸性溶液 |
| C |
检验CH3CH2Br在NaOH溶液中是否发生了水解 |
将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| D |
除去苯中混有的苯酚 |
向混合液中加入过量浓溴水,充分反应后,过滤 |