用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是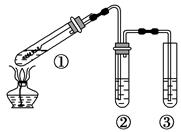
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.为确认CuSO4生成,向①加水,观察颜色 |
25℃时,下列说法正确的是()
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl—)>c(NH4+) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3—) >c(H2CO3)>c(CO32−) |
| C.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后所得溶液显酸性 |
| D.将0.1 mol/L的氨水溶液加水稀释10倍,溶液中离子浓度都减少 |
下列有关物质的性质与其应用不相对应的是( )
| A.Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 |
| B.NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 |
| C.NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏 |
| D.K2FeO4能与水作用生成Fe(OH) 3胶体和O2,可用于自来水的净化和杀菌消毒 |
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH—2e—→X+2H+.下列说法中正确的是( )
| A.电池内部H+由正极向负极移动 |
| B.另一极的电极反应式为:O2+4e—+2H2O=4OH— |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池总反应为:2CH3CH2OH + O2→2CH3CHO + 2H2O |
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.常温下,Al能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A.Y的最高化合价为+6 |
| B.离子半径:W>Q>Y>X |
| C.氢化物的沸点:Y>Q |
| D.最高价氧化物的水化物的酸性:W>Q |
下列叙述正确的是( )
| A.碳酸氢钠溶液可用于区分乙酸、乙醇和苯 |
| B.糖类、油脂、蛋白质都是高分子化合物,都可以在一定条件下发生水解反应 |
| C.用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 |
| D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |