(14分)今有aX、bY、cZ三种元素。
已知:
①各原子序数a、b、c均小于20,且a+b+c=25;
②元素Y的原子外围电子构型为ns2npn+2;
③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;
④Z的硫化物的相对分子质量与Z氯化物的相对分子质量之比为38:77。
据上可推知,
(1)X、Y、Z三种元素形成的常见化合物的化学式是_________________。
(2)X2Y2是________晶体(填晶体类型),构成晶体的微粒是________(填微粒符号) ,该晶体中微粒间的作用有__________________________________。
(3)Z的硫化物和氯化物的分子空间构型分别是____________、__________,其中Z原子分别以______杂化轨道成键,根据成键方式分类,Z的硫化物分子中含有的键的种类及其数目是______________。
(4)Z的氢化物种类很多,写出Z的氢化物分子中所有原子都在同一平面上的任意两种简单的化合物的名称_________、__________。
【化学—选修2 化学与技术】
最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如图: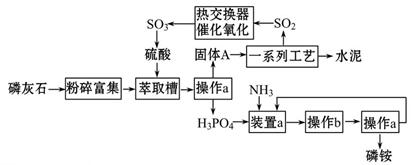
回答下列问题:
(1)实验室模拟萃取槽需要用到玻璃仪器为: ,操作b的名称是______________。
(2)装置a中生成两种酸式盐,它们的化学式分别是_______________。
(3)依题意猜测固体A中一定含有的物质的化学式是____________________(结晶水部分不写)。
(4)热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是________________________。
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是___________________。
| A.NaOH溶液、酚酞试液 | B.KMnO4溶液、稀硫酸 |
| C.碘水、淀粉溶液 | D.氨水、酚酞试液 |
随着电子工业的发展,电子垃圾的数量逐渐增多,对环境构成了极大的污染。某化学兴趣探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):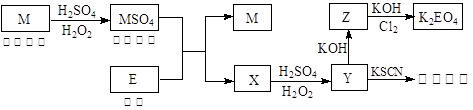
(1)写出Z与Cl2、KOH反应生成K2EO4的离子方程式: 。
(2)检验X中阳离子的方法和现象是 。
(3)如果各步转化无损失,M转化为MSO4消耗的H2O2与X转化为Y消耗的H2O2的用量之比为:
。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有 、 、 (填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。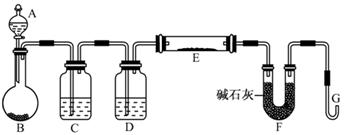
①如果去掉装置C,则测定的M的相对原子质量 (填写偏高、偏低、正常),装置D的作用 ;
②连接好装置并检验装置的气密性,检验气密性的方法是:
。
然后应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ? 在这两步之间还应进行的操作是 。
I. 铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)溶液B经过 、 、 可得到氯化铜晶体;
(2)检验溶液B中是否存在Fe3+的方法是 ;
(3)下列物质适合于调节溶液的pH得溶液B的是
A.NaOH溶液 B.CuCO3 C.氨水 D CuO
(4)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 ;
II. (1)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷
酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料。
①若氨水与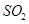 恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
常温下弱电解质的电离平衡常数如下:氨水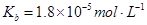
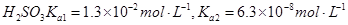
②向②中溶液中通入________气体可使溶液呈中性。(填“SO2”或NH3”)此时溶液中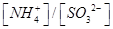 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)
(2)向0.2mol•L‾1 NaOH 溶液通入过量CO2,充分反应后所得溶液中离子浓度大小顺序为
___________________________________ 。
硫及其化合物和氮及其化合物在化学工业、环境保护中应用非常广泛。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致酸雨的形成,收集SO2形成的酸雨,pH逐渐减小,一定时间后pH不再变化,写出酸雨中反应的离子方程式 。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。己知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890.3l kJ·mol-1
2NO(g)+O2(g)=2NO2(g)ΔH=-112.97 kJ·mol-1
写出CH4(g)催化还原NO(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式: 。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,已知2SO2(g)+O2(g) 2SO3(g),△H=" —196" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K= ,用SO2表示的反应速率为 。
2SO3(g),△H=" —196" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),5分钟后反应达到平衡,共放出热量196kJ,该温度下此反应的平衡常数K= ,用SO2表示的反应速率为 。
②一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
| A.保持温度和容器内压强不变,充入1mol Ar |
| B.保持温度和容器体积不变,充入2 mol N2 |
| C.保持温度和容器体积不变,充入2 mol SO3 |
| D.升高温度 |
E.移动活塞压缩气体
(4)某人设想以右图所示装置,用电化学原理生产硫酸,通入O2的电极为 极,写出通入SO2的电极的电极反应式 。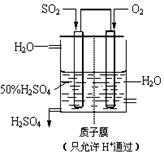
[物质结构与性质]
铜、碳、氮、氧、硫、氯等是组成物质的重要元素。
(1)根据等电子体原理,羰基硫(OCS)分子的结构式应为 。光气(COC12)分子内各原子最外层都满足8电子稳定结构,则光气分子的空间构型为 (用文字描述)。
(2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子:
①写出Cu(Ⅰ)的电子排布式 ;
②该离子中含有化学键的类型有 (选填序号);
| A.非极性键 | B.离子键 | C.配位键 | D.极性键 |
③该离子中C原子的杂化方式有 。
(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图所示。写出M的化学式 。