( 9分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1 821 |
15 390 |
21 771 |
| B |
738 |
1 451 |
7 733 |
10 540 |
①某同学根据上述信息,某同学推断B的核外电子排布如图所示,该同学所画的电子排布图违背了________。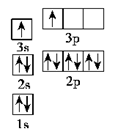
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为____________。A原子杂化类型是_______________。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为145~140 pm,有同学据此认识C60的熔点高于金刚石,你认为是否正确__________理由是____________________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为____________。晶胞中每个C60分子周围与之等距离且最近的C60分子数是_________。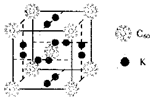
③继C60后,科学家又合成了Si60、N60;C、Si、N原子电负性由大到小的顺序是____________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为________。
(3)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。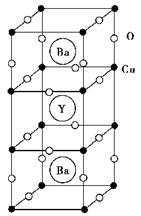
①根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,其化学式________。
②已知该化合物中各元素的化合价Y为+3价,Ba为+2价,Cu为+2价和Cu为+3价,根据①所推出的化合物的组成,试计算化合物中这两种价态Cu原子个数比_______________。
③Ba2+的配位数为___________。
按要求回答下列问题
(1)石墨晶体中C-C键的键角为。其中平均每个六边形所含的C原子数为个。
(2)金刚石晶体中含有共价键形成的C原子环,其中最小的C环上有个C原子。
(3)CsCl晶体中每个Cs+周围有个Cl-,每个Cs+周围与它最近且距离相等的Cs+共有个。
(4)白磷分子中的键角为,分子的空间结构为,每个P原子与 个P原子结合成共价键。若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合个氧原子,若每个P原子上的孤对电子再与氧原子配位,就可以得到磷的另一种氧化物(填分子式)。
(5)二氧化硅是一种晶体,每个硅原子周围有个氧原子。
已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:
(1)若X、Y均为非金属元素,写出你所知道的XY2的化学式__________、___________、_________、______________等。
(2)若X原子的外围电子层排布为3d104s2,Y可能是___元素或 ___元素(写元素符号)。
(3)若Y的阴离子与Ar有相同的电子层结构,则X的原子外围电子层排布构型有:
_______、________、_________、_______、________、________。
已知A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1∶1,A的相对分子量小于30,在下图变化中,中间产物C跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生砖红色沉淀,E有香味,(反应条件未写出)。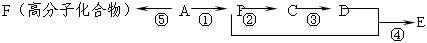
写出下列各步变化的化学方程式,并注明反应条件。
反应①;
反应②;
反应④;
反应⑤;
比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。乙烯和氯化氢在一定条件下制得氯乙烷,该反应的原子利用率为,决定氯乙烷能用于冷冻麻醉应急处理的具体性质是
已知乳酸的结构简式为 。试回答:
。试回答:
(1)乳酸分子中含有和两种官能团(写名称);
(2)乳酸与金属钠溶液反应的化学方程式为
(3)乳酸与Na2CO3溶液反应的化学方程式为
(4)当乳酸和浓硫酸共热时,能产生多种酯类化合物,任意写出两种该类产物的结构简式、