在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下: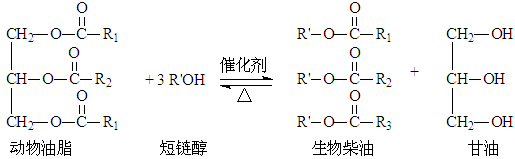
下列叙述错误的是
| A.生物柴油由可再生资源制得 | B.生物柴油是不同酯组成的混合物 |
| C.“地沟油”可用于制备生物柴油 | D.动植物油脂是高分子化合物 |
下列关于金属晶体的叙述正确的是( )
| A.常温下,金属单质都以金属晶体形式存在 |
| B.金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失 |
| C.钙的熔沸点低于钾 |
| D.温度越高,金属的导电性越好 |
人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO3- H2CO3
H2CO3 CO2+H2O
CO2+H2O
H++PO43- HPO42-
HPO42-
H++HPO42- H2PO4-
H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
| A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定 |
| B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定 |
| C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒 |
| D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小 |
100mL 0.1 mol·L-1醋酸与50mL 0.2 mol·L-1氢氧化钠溶液混合,在所得溶液中
| A.C(Na+)>C(CH3COO-)>C(OH-)>C(H+) |
| B.C(Na+)>C(CH3COO-)>C(H+)>C(OH-) |
| C.C(Na+)>C(CH3COO-)>C(H+)=C(OH-) |
| D.C(Na+)=C(CH3COO-)>C(OH-)>C(H+) |
25 ℃时,水的电离达到平衡:H2O H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH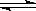 CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |