下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热 |
未出现红色沉淀 |
葡萄糖中不含有醛基 |
| B |
向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 |
试管口出现红棕色气体 |
溶液中NO3-被Fe2+还原为NO |
| C |
等体积pH=3的HA和HB两种酸分别与足量锌反应,用排水法收集气体 |
HA放出的氢气多且反应速率快 |
HA酸性比HB强 |
| D |
向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 |
红色逐渐褪去 |
Na2CO3溶液中存 在水解平衡 |
一定条件下,向容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。
CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。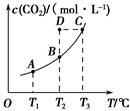
| A.0~5 min,CO2的平均反应速率为0.04 mol·(L·min)-1 |
B.反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH<0 CH3OH(g)+H2O(g)的ΔH<0 |
| C.在T2℃时,若反应处于状态D,则一定有v正<v逆 |
| D.若T1℃、T2℃时的平衡常数分别为K1、K2,则K1>K2 |
利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收CO,能达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
[Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
| 温度/℃ |
15 |
50 |
100 |
| 化学平衡常数 |
5×104 |
2 |
1.9×10-5 |
下列说法正确的是 ( )。
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)]Ac·CO Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
C.保持其他条件不变,减小压强,CO的转化率减小
D.醋酸二氨合铜溶液的浓度大小对CO的吸收没有影响
对于可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是 ( )。
4NO(g)+6H2O(g),下列叙述正确的是 ( )。
| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5 |
| B.反应达到平衡时,对体系充入稀有气体并加压,平衡总是向逆反应方向移动 |
| C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动 |
| D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡 |
在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是( )。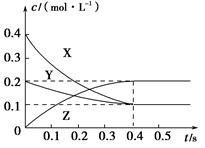
A.反应可表示为3X+Y 2Z 2Z |
| B.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1 |
| C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大 |
| D.升高温度,平衡常数一定增大 |
下图是N2与H2反应生成NH3的过程中能量变化的曲线图:下列叙述正确的是( )。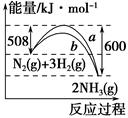
| A.该反应的热化学方程式为 N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |