溴化钙是一种溴化物,用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr2·2H2O的主要流程如下: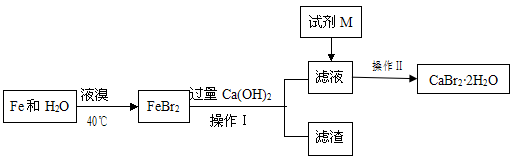
(1)制备FeBr2时可用如下实验装置(部分夹持装置略去),水浴加热。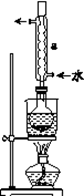
仪器a的名称是________,与液溴的反应温度不能超过40℃的原因是 。
(2)滤渣的成分可能是 。
(3)试剂M是 ,加入M的目的是 。
(4)操作Ⅱ的步骤为蒸发浓缩、 、 、洗涤、干燥。
(5)溴化钙晶体中溴离子的检验:将少量溴化钙晶体溶于水,加入 ,实验现象为 ,发生反应的离子方程式为 。
(6)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式 。
(7)制得的CaBr2·2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g固体,则CaBr2·2H2O的质量分数为 。
已知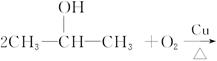
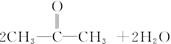
CH22CH3CH2OH+O2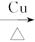 2CH3CH2CHO+2H2O
2CH3CH2CHO+2H2O
C3H7X+NaOH C3H7OH+NaX
C3H7OH+NaX
试参考以上反应及有关物质的性质,用实验确定某卤代烃C3H7X分子中X的位置和种类(X可能是Cl、Br、I三种原子中的一种)。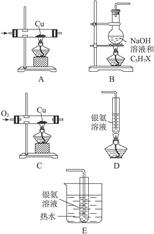
图6-14
(1)试从图6-14中选出适当的几种实验装置并连成一整套,以达到上述实验目的(用编号回答并用→连接)___________。
(2)反应完毕后,若盛有银氨溶液的试管中有银镜产生,则C3H7X的结构简式为___________;再取少量B烧瓶中的液体,冷却并用稀硝酸酸化后,再滴入___________,若产生淡黄色沉淀,则X为___________原子。
如下图所示为实验室制取少量溴苯的装置,完成下列问题: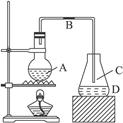
(1)烧瓶A中装的物质为____________________________________,发生反应的化学方程
式为________________________________。
(2)导管B的主要作用是______________________________________________。
(3)导管C处附近会出现白雾,其原因是
____________________________________________。
(4)反应后,向锥形瓶中滴加AgNO3溶液时,观察到的现象是_____________________,相应的离子方程式为______________________________________________。
(5)反应后,将烧瓶A中的液体倒入盛有冷水的烧杯中,烧杯底部有___________色的油状液体,带颜色的原因是________________________________,可用__________________的方法将颜色除去。
(8分)已知在烯烃R—2CH==1CH2与HBr加成反应中,Br原子参与成键的方式有两种可能:①Br原子在1C上成键;②Br原子在2C上成键。化学兴趣小组拟用0.224 L丙烯(标准状态)与足量HBr进行加成反应,希望通过定量实验的方法探究其加成方式,实验步骤如下:
(一)丙烯与HBr在适当条件下加成得到卤代烃;
(二)卤代烃在NaOH水溶液中加热;
(三)提纯得到混合醇;
(四)将混合醇蒸气通过足量的灼热铜网;
(五)导出产物,通入足量的银氨溶液中,进行银镜反应实验,完全反应后最终得到W克银。
完成下列问题:
(1)步骤(三)中提纯混合醇的简单物理方法是:将含混合醇的混合物进行__________。
(2)实验中如何测量生成银的质量?
(3)写出步骤(四)中的任意一个化学反应方程式。(只写一个)
(4)小组成员预期可能实验结果及结论?(提示:结论应具有普遍性,参考形式如“烯烃与HBr加成的方式为①/②”)
(8分)实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法来制备1-溴丁烷时,还会有烯、醚和溴等副产物生成,反应结束后将反应混合物蒸馏,分离得到1-溴丁烷。已知有机物具有如下性质:
| 熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
|
| 正丁醇 |
-89.53 |
117.25 |
0.81 |
| 1-溴丁烷 |
-112.4 |
101.6 |
1.28 |
| 丁醚 |
95.3 |
142 |
0.76 |
| 1-丁烯 |
-185.3 |
-6.5 |
0.59 |
试完成下列问题:
(1)生成1溴丁烷的反应的化学方程式是______________________________________。
(2)反应中由于副反应而生成副产物的反应类型是______________________________。
(3)反应加热的温度应__________100 ℃(填“大于”“小于”或“等于”)
(4)反应结束时,从反应混合物中蒸馏得到1-溴丁烷时,应控制的温度范围是____________;选用的装置应是图中的__________ (填序号)。
(5)蒸馏得到的馏分中可能含有的杂质主要是__________,将其进一步除去的方法是________________________________________。
(10分)实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取W g该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按图所示装置进行实验。
请完成下列有关问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是______________________。
(2)装置图中需要加热的仪器有__________:(用字母填空,下同),操作时应先点燃__________处的酒精灯。
(3)A装置中发生反应的化学方程式是______________________________________。
(4)D装置的作用是______________________________________________________。
(5)读取N2的体积时,应注意:①___________;②___________。
(6)实验中测得N2的体积为V mL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据有___________ (用字母填空)。
| A.生成二氧化碳气体的质量 |
| B.生成水的质量 |
| C.通入氧气的体积 |
| D.氨基酸的相对分子质量 |